
EN

全球生物製藥迎來複蘇:淺析行業發展趨勢及挑戰
判斷生物製藥行業是否景氣有個重要指標:獲批並上市的新藥物的數量。經曆了長期的今年估計衰退後,近期生物製藥行業迎來了複蘇。除此以外,行業的一些其他的主要發展和趨勢也可以幫助我們進一步地了解這個行業的情況,對行業現狀進行更加精確地評估,並對將來作出預測。這些趨勢已經以年度評點的形式發表在相關期刊,行業的各個重大事件都在該文中提及。
頭條新聞是埃博拉病毒
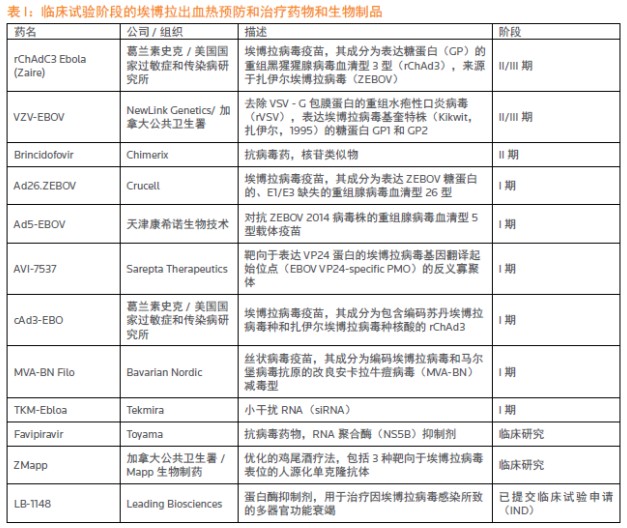
2014年醫療方麵最重大的新聞是西非爆發的埃博拉疫情。截至2015年2月20日,全球共有2.34萬人感染埃博拉病毒,9450人因此死亡。這次埃博拉疫情是曆史上最大的一次,並且首次影響到西方國家。疫情爆發前,隻有極少數針對埃博拉病毒的藥物和疫苗,而且這些在研產品都還處在臨床前試驗階段。但疫情爆發後幾個月,隨著受感染人數“火箭式”迅猛增加,在各個機構包括世界衛生組織(WHO)、美國國家過敏和傳染病研究所(NIAID)和美國疾病預防控製中心(CDC)的鼓勵和支持下,製藥公司開始努力開發預防埃博拉病毒的疫苗和治療該感染的藥物。這直接導致,到去年年底,有12個產品進入臨床研究階段(見表1)。雖然所有的跡象都表明,這些候選疫苗和藥物基本上沒有可能及時獲得監管部門的批準,在這次疫情中發揮作用,但是在如此短的時間內製藥行業取得如此大的進展,足以展示當麵對大規模健康危機時,公共健康機構和製藥公司的應對能力。
人見人愛的孤兒藥
用於罕見病的孤兒藥雖然針對的患者群很小,但由於投資回報率非常高,所以製藥公司此類藥物的開發越來越予以重視。這一變化的結果顯而易見:2014年首次上市的84個新藥中有15個在上市地區獲得孤兒藥地位,比例將近18%。與此相對應,自1983年美國孤兒藥法案頒布後的十七年間,總共隻有34個罕見病藥物上市。
目前,人類已經發現了大約7000種罕見病,所以有足夠的空間留給製藥公司去發揮,創造出類似Ataluren(Translarna)的成功範例。去年,這個用於治療杜氏肌營養不良症的藥物在歐盟獲得批準,並已經在德國上市銷售。
2014年,美國、歐盟、日本和澳大利利亞的監管機構給予超過400種藥物孤兒藥地位。這些孤兒藥中,大多數是用於一些罕見的癌症或者是先天性代謝缺陷的,其他的適應症包括多發性硬化症、囊性纖維化、埃博拉病毒感染、真菌感染和色素性視網膜炎等。
不斷“刷新”的在研產品線
有限的資源、嚴格的監管要求加上來自於競爭對手和股東的持續不斷的壓力,所有這些因素都迫使製藥公司不斷地對在研產品進行淘汰,隻留下最有希望的候選藥物。將已經進入到後期階段臨床試驗的在研項目停止原因很多,包括療效不佳、安全性問題、患者入組或研究設計問題,或者處於戰略性的考慮,比如市場規模、獲批的可能性、資源的再分配以及在研產品線的優化。
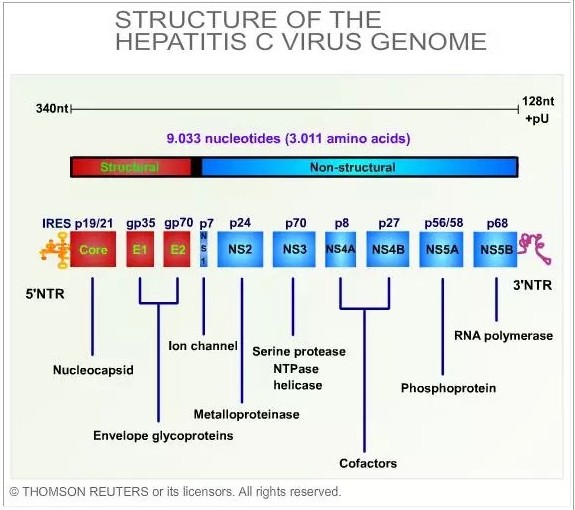
有時候,一些公司的好消息恰恰是另一些公司的壞消息。最明顯的例子莫過於去年的丙肝藥物治療市場,這個領域在過去五年發生的變化令人目不暇接。在2011年前,還沒有任何用於丙肝治療的特異性酶抑製劑麵世,當時最好的治療方法是幹擾素加廣譜抗病毒藥物利巴韋林。但這個方法隻能部分消滅病毒,而且需要長期治療,並會導致嚴重的、令人虛弱的副作用。大約十年前,科學家們對丙肝病毒有了更多的了解(見圖1),使得研究人員得以設計出靶向於丙肝病毒生命周期的藥物。其結果就是,從2011年開始,新的直接作用於丙肝的藥物如潮水一樣被開發出來。最早的產品是2011年上市的丙肝病毒NS3蛋白酶抑製劑boceprevir和NS3/NS4A蛋白酶抑製劑telaprevir。隨後,又有六個新的丙肝藥物和兩個個固定劑量的複方藥成功上市。
圖1:丙肝病毒基因組結構
由於眾多新的抗丙肝藥物迅速衝進市場,去年一些公司決定不再繼續對在研產品線中的同類產品進行投資,以減少損失。比如勃林格殷格翰(Boehringer Ingelheim)就砍掉了兩個項目:聚合酶抑製劑deleobuvir和丙肝病毒NS3蛋白酶抑製劑faldaprevir。行業內幾十個在研的同類產品使得勃林格殷格翰做出這個務實的決定。
中風治療藥物的開發非常困難,臨床試驗成功率很低。2014年12月,靈北(Lundbeck)公司宣布決定中止開發用於急性缺血性腦卒中的重組纖溶酶原激活劑去氨普酶(desmoteplase),同時停止DIAS-4試驗的患者招募,原因是之前DIAS-3試驗數據的分析發現,這個藥不可能達到DIAS-4試驗的主要終點。這個藥物安全性良好,而且某些患者可以從治療中獲益,但是公司沒有考慮清楚應該選擇哪一類亞組患者進行進一步的研究。靈北公司目前正在評估各種方案,其中包括不再繼續開發去氨普酶項目。另一家公司Cytomedix去年也停止了中風藥物ALD-401的開發,原因是療效不佳。
查格斯氏病(Chagas disease,也稱美洲錐蟲病)是一種傳染病,每年在拉丁美洲有幾百萬人感染此病。但是,被忽略疾病藥物組織(Drugs for Neglected Diseases Initiative,DNDI)宣布不再繼續資助E-1224的開發,原因是單藥治療的II期臨床試驗結果顯示,該藥缺乏持續療效。這一決定使得原本就隻有三個的用於查格斯氏病治療的在研藥物減少到兩個。好消息是,DNDI宣布E-1224與苄硝唑聯合治療的研究即將進行。

分享到:














 相關新聞
相關新聞