
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




缺乏明顯療效是新藥開發失敗的最重要原因。雖然動物和人,疾病模型和疾病本身有著巨大區別,但實驗動物模型依然是預測後期臨床療效,降低臨床開發風險的最重要步驟之一。之前我們討論了如何對待動物實驗的療效數據,比如動物實驗要評價(一)療效的大小,是否統計性顯著、(二)陰性/陽性對照是否異常、(三)量效曲線是否異常、(四)重複性、(五)生物標記,療效是否通過項目靶點而產生等因素。現在我們談談抗腫瘤動物模型的演變。
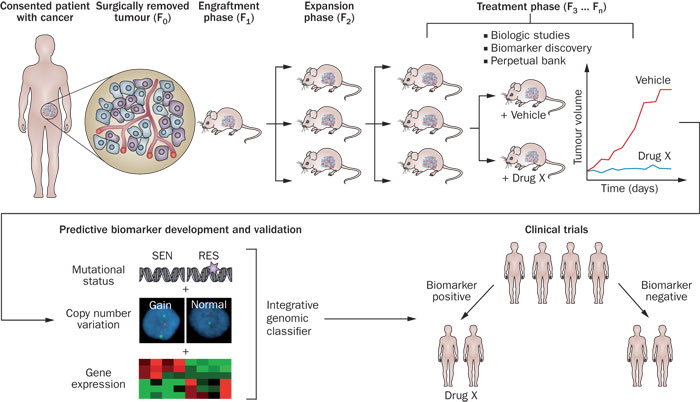
腫瘤是在新藥開發過程中動物模型較完善的一門學科。即使如此,臨床前的療效還常常不能轉換化到臨床認證。目前常見的腫瘤動物模型有小鼠接種腫瘤模型(包括鼠源或人源)、皮下異位移植腫瘤模型(PDX,包括體外生長或直接來自患者)、原位移植腫瘤模型(PDOX,轉移性腫瘤模型)、轉基因“腫瘤鼠”模型、以及“Xenopatients/Avatars”等。小鼠接種模型因為操作簡易、成瘤率高、價格低廉等原因,尤其作為篩選模型而被廣泛應用於抗癌藥物研發。1969年,Rygaard and Povlsen醫生首次把來自一個71歲直腸癌腫患的腫塊直接移植到缺乏胸腺細胞和T細胞的小鼠(裸鼠)改變了腫瘤研究領域。1這是人類首次把人類腫瘤腫塊移植到小鼠皮下生長,開始了腫瘤研究的新紀元。
皮下異位移植腫瘤模型(PDX)通常把來自患者腫瘤的腫塊直接移植到免疫缺陷小鼠的皮下。與傳統細胞株建立的腫瘤模型相比,異位移植腫瘤模型減少了體外培養步驟,保持了臨床腫瘤細胞的形態和分子生物學特征,因而更好地模擬人類腫瘤並預測臨床療效。雖然在小鼠皮下生長的腫瘤和供體的高分化腺癌相似,但是大多數人體實體瘤在免疫功能低下的小鼠皮下種植不發生轉移,轉移性細胞株移植皮下之後也伴隨著極低的轉移率。受體/靶點/靶蛋白的表達情況也可能發生變化,因此不能很好地模擬人類腫瘤的微環境,從而影響了它在研究人類腫瘤轉移特征方麵的價值。
Sordat課題組是最早報道原位移植腫瘤模型(PDOX)的實驗室之一。2PDOX是將患者腫塊(或細胞/組織)移植到該腫瘤的源發器官,比如肝癌實體瘤(細胞)移植到肝髒、胃癌腫塊(細胞)移植到胃,這樣保持了腫瘤組織與其起源相同的體內微環境,相對異位移植具有更高的臨床相關性,降低假陽性發生率。尤其重要的是原位移植模型的腫瘤類似人體腫瘤容易發生轉移。1982年,Sordat研究團隊把直腸癌細胞株注入裸鼠的大腸,長出腫瘤且腫瘤發生轉移。後來的研究表明,腫瘤在宿主體內表達侵襲轉移能力,不但需要具備合適的移植環境,而且還依賴於腫瘤細胞之間、腫瘤細胞與宿主之間的相互作用。原位移植比通過尾靜脈、門靜脈、左心室、骨、脾、淋巴結等多途徑注射腫瘤細胞引起的腫瘤轉移更能模擬人類腫瘤轉移。除了直接移植患者腫塊和原位接種腫瘤細胞之外,原位移植腫瘤模型還可以先在皮下接種,成瘤後再移植至小鼠的原發器官。這樣先讓人源腫瘤組織在裸鼠皮下適應裸鼠體內環境,然後再接種於原發器官,有利於保證移植瘤的存活率。這類技術與直接原位移植瘤模型一樣充分展示人源腫瘤的生物學特性,與裸鼠皮下和腹腔移植瘤相比,其侵襲和轉移能力均優於後者。自上世紀九十年代起,人們已經廣泛使用來自患者的原位移植瘤模型,其中包括直腸癌、胰腺癌、乳腺癌、卵巢癌、肺癌、以及胃癌模型等。
1988年4月,哈佛大學的Philip Leder和Timothy Stewart通過基因工程的方法,培育了一種高度易感乳腺癌的小鼠。這種轉基因的“腫瘤鼠”(也叫哈佛鼠)的Myc基因能被對激素敏感的鼠源乳腺腫瘤病毒誘導產生乳腺癌。“哈佛鼠”的專利申請也作為首例動物專利曾在十多年前被炒得沸沸揚揚。“腫瘤鼠”具有免疫活性,而不是象裸鼠那樣具有免疫缺陷,能夠研究腫瘤在腫瘤周圍組織的微環境中的發展以及抗癌藥物的分子和組織病理學影響。而且這種自發性“腫瘤鼠”模型可以明顯縮短動物模型的實驗周期。再後來又開發了更複雜實驗技術,其中包括同源重組、以及Cre-loxP係統激活腫瘤基因和敲除特定器官的腫瘤抑製基因等。在過去二十餘年轉基因“腫瘤鼠”模型尤其在科研機構曾一統天下,占據腫瘤動物模型的大半壁江山。
2006年,約翰?霍普金斯大學的Hidalgo課題組報道采用嚴重免疫缺陷小鼠建立的移植瘤小鼠模型。比如他們使用一類肥胖糖尿病聯合免疫缺陷(NOD-SCID)的小鼠,但是這種小鼠模型的腫瘤依然不大會轉移。為了和五十年前的異位移植模型顯示區別,Hidalgo課題組賦予這個老模型一個新名稱—“Xenopatients”或“Avatars”。筆者認為這類模型是新瓶裝舊酒,而且這類“新瓶裏的舊酒”在2014年10月竟被登上《科學》雜誌封麵3。50年過去了,腫瘤動物模型幾乎又回歸當初,今天藥廠廣泛采用的腫瘤移植模型和Rygaard/Povlsen當初的實驗沒有什麽本質上的區別。