中美藥審報告第二季——遇見重磅!
5個品種特別值得關注:FDA審批信息中,全球首個獲批的“雙下巴”溶脂針KYBELLA,以及獲得優先審評的心衰用藥CORLANOR;國內批文中,江蘇恒瑞申請生產的一類化藥磷酸瑞格列汀和上海仁會的一類生物藥貝那魯肽,以及申報臨床的歌禮生物的口服免幹擾素治療慢性丙肝藥ASC16。
不知不覺中,2015年已過去了一半。國內藥物市場的景象是,基藥、非基醫保及非基非醫保藥物招標的風生水起,結果是有人歡喜有人愁;國際醫藥界看似平靜,其實暗流湧動,各種大手筆的成交擬成交、收購被收購消息滿天飛。
撇開紛擾直擊本質,大家追求的無非是最具競爭力的產品。對於產品,企業家比的是發現有市場價值藥物的眼光,市場人員比的是把握市場主流方向的能力,研發人員比的是開發新產品的實力。大家不遺餘力地追逐新藥,以期獲得像丙肝藥Sovaldi這樣的超級重磅炸彈。
為此,我們將第二季獲批的藥物展示給大家,看看有那些藥物具備了重磅的潛力。
美國
1數據總覽:沒有新生物藥
2015年4~6月,FDA公布了875條審批信息。其中,4月份有327條審批信息,包括NDA(新藥申請)250條、BLA(生物製品申請)7條、ANDA(簡略新藥申請)70條。這其中包含55條批準信息,19條臨時性批準信息,其餘為標簽變更、補充臨床數據等相關信息。批準信息最多的藥品是神經係統藥物ARIPIPRAZOLE(阿立呱唑,ANDA),因其美國專利到期,共計包括梯瓦等4家企業的仿製藥獲批,再加上前幾年有6家獲得臨時批準,該品目前共計有10家仿製藥企業獲得批文。阿立呱唑是施貴寶和大塚的抗精神病重磅藥,曾經取得過輝煌的戰績。
5月份共計253條審批信息,包括NDA信息181條、BLA信息16條、ANDA信息31條。其中包含48條批準信息,14條臨時性批準信息,其餘為其他相關信息。
6月份共計295條審批信息,包括NDA信息222條、BLA信息4條、ANDA信息69條。其中包含63條批準信息,6條臨時性批準信息,其餘為其他相關信息。第二季批準4個新分子實體,沒有批準新的生物製品。
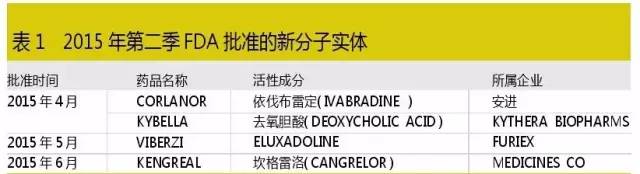
本季度雖然批準的創新藥少於第一季,但是獲批的4個新分子實體中就有2個藥物具有重磅藥的潛力:一個是全球首個獲批的“雙下巴”溶脂針KYBELLA,另一個是獲得優先審評的治療心衰藥物CORLANOR。
鑒於心力衰竭是成年人死亡和殘疾的的主要原因,而Corlanor被認為是通過減低心率作用和代表在這個藥物類別第一個被批準的產品,因而被賦予了巨大的市場想象。而剛剛過去的7月7日,製藥巨頭諾華備受矚目的慢性心衰藥物Entresto(原LCZ696)提前6周獲得FDA批準,該藥是過去25年內心衰治療領域的一個偉大突破,業界預測其年銷售峰值將超過60億美元。
作為首個也是唯一一個非手術治療產品,溶脂針KYBELLA可用於中度至重度“雙下巴”成人,也成為同類產品中首個獲批用於美容的注射針劑。其原研公司Kythera Biopharmaceuticals也因該產品被新晉醫藥航母艾爾健以21億美元收購。新艾爾健是阿特維斯以705億美元並購肉毒杆菌製造商艾爾健而成立的公司,它締造了一個超過醫藥巨頭百時美施貴寶、禮來及艾伯維的新航母,市值達1170億美元。憑借其美容肉毒杆菌藥物Botox(保妥適)的成功銷售經驗和團隊,KYBELLA成為重磅藥的幾率相當高。
3亮點二:兩隻臨時性批準化藥
本季度雖無創新生物藥獲批,但兩個獲得臨時性批準的化藥還是引起了我們的關注。
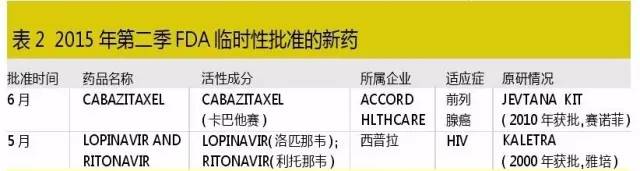
其中一個是治療前列腺癌的卡巴他賽。由於前列腺癌在歐美發病率較高,賽諾菲的原研藥JEVTANA KIT(卡巴他賽)於2010年6月獲得了優先審評用於該疾病,年報顯示2014年此品種為賽諾菲賺取了2.73億歐元。由於其專利將在明年到期,ACCORD HLTHCARE的產品獲批,不僅為市場提供多一種選擇的機會,也讓製藥公司得以提前布局。
另一個獲臨時批準的藥物是印度西普拉治療HIV的藥物LOPINAVIR AND RITONAVIR,它是一種新配方的新劑型微丸。微丸作為一種具有流動性好、生物利用度高等特點的劑型,近來獲得大家的追捧,雖然市場已有諸如片劑等數家企業有批文,但無疑西普拉的市場決心最大,它擁有片劑、溶液劑和微丸的批文。
中國
國內市場方麵,在經曆了藥品招標等一係列政策洗禮之後,各企業都急需有競爭力的新鮮血液來補充自己的產品庫。那麽,第二季獲批的藥物又有哪些看點呢?
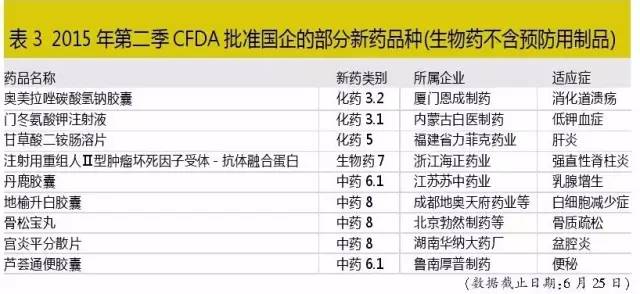
1生產批文平淡缺少亮點
米內網藥品審評數據庫顯示,4~6月,國內藥企共獲得110個生產批文(生物藥不含預防用製品)。其中4月份55個批文,5月份37個,6月份18個;110個批文中,有31個批文涉及補充申請項;新獲批文79個,其中中藥37個,治療用生物藥3個,其餘為化藥批文。在新批文中,有近半數為新藥批文。但是,新藥批文中,除海正的生物藥有看點外,大多平淡無奇,主要是在劑型上做了些許改變。
2全球同步注冊的進口藥
在國內藥物注冊方麵,有些現象值得關注。比如在進口藥物注冊領域,我們發現,越來越多的製藥巨頭將一些沒有上市的新藥拿到國內來進行申報。綜合2015年一季度的數據可以發現,有多個真正意義上的創新藥在國內申報臨床,其中大多數落在抗腫瘤領域,如禮來的LY2157299及諾華的LEE011等均為抗腫瘤藥物。
LY2157299(Galunisertib)是一種TGF-β受體激酶抑製劑,該產品在2013年底在國內進行申報,於今年4月獲準進行臨床。LY2157299在國外進行的相關臨床也在如火如荼地進行中,有的項目已經完成,有的項目還在進行中或還在招募狀態。
有外企進入我國申報,也就有國內企業奔赴海外。百濟神州的用於治療惡性腫瘤的BGB-3111今年2月在國內申報臨床,而同時它的BGB-3111和BGB-290等也已獲準在美國進行臨床試驗。
3三隻點讚的本土創新藥
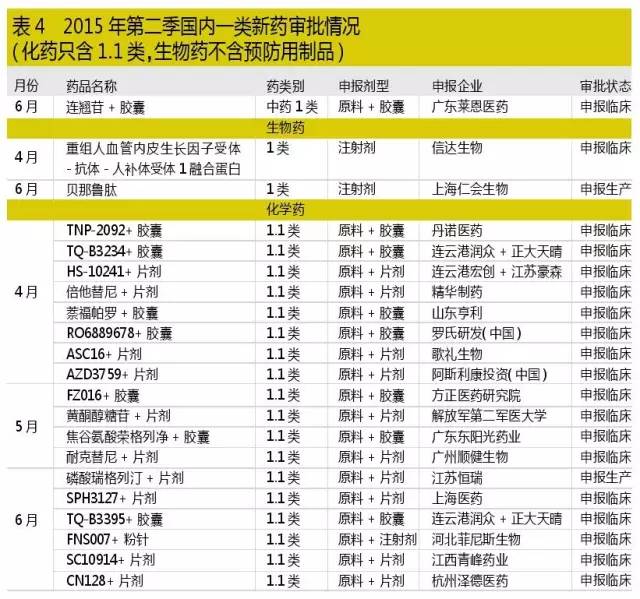 本土創新藥注冊方麵,江蘇恒瑞申請生產的一類化藥磷酸瑞格列汀和上海仁會的一類生物藥貝那魯肽,我們應該給出掌聲。對於長期從事藥物研發的專業人員來說,大家都明白一個事實:一般來說,一類新藥申報臨床相對較為容易,而成功完成大資金投入的臨床試驗後進入申報生產,才體現了企業的實力和決心,因此我們必須給這樣的企業點讚。
對於勇於創新摸索的企業,我們也應懷有敬意,歌禮生物的全口服免幹擾素治療慢性丙肝藥ASC16申報臨床,是繼去年同類藥物ASC08申報成功後再次向CDE提出申請。吉利德的口服免幹擾素治療方案在去年獲得全球的關注,引發了此類藥物的研發熱潮,歌禮在國內首家推出此類方案,對推進我國丙肝防治意義重大。
本土創新藥注冊方麵,江蘇恒瑞申請生產的一類化藥磷酸瑞格列汀和上海仁會的一類生物藥貝那魯肽,我們應該給出掌聲。對於長期從事藥物研發的專業人員來說,大家都明白一個事實:一般來說,一類新藥申報臨床相對較為容易,而成功完成大資金投入的臨床試驗後進入申報生產,才體現了企業的實力和決心,因此我們必須給這樣的企業點讚。
對於勇於創新摸索的企業,我們也應懷有敬意,歌禮生物的全口服免幹擾素治療慢性丙肝藥ASC16申報臨床,是繼去年同類藥物ASC08申報成功後再次向CDE提出申請。吉利德的口服免幹擾素治療方案在去年獲得全球的關注,引發了此類藥物的研發熱潮,歌禮在國內首家推出此類方案,對推進我國丙肝防治意義重大。

分享到:


















 相關新聞
相關新聞