
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




10月看點 一、化藥 2.仿製藥 二、中藥 三、生物製品
-10月藥品申報受理數量降至2015年最低
-四環醫藥再次申報1.1類新藥
-瑞陽、四川百利同時搶仿孤兒藥納呋拉啡
-賽諾菲提交骨關節炎和幹細胞動員治療藥物上市申請
-9個1.1類新藥獲批臨床,大多為抗腫瘤藥
-獲批臨床的3.1類新藥占67.96%
-羅氏抗體-藥物共軛物ado-trastuzumab emtansine申報臨床
根據丁香園 Insight-China Pharma Data數據庫最新統計, 2015年10月CDE共承辦新的藥品注冊申請有548個(以受理號計,下同)。
10月份申請數量比9月下降了14.9%,達2015年最低峰。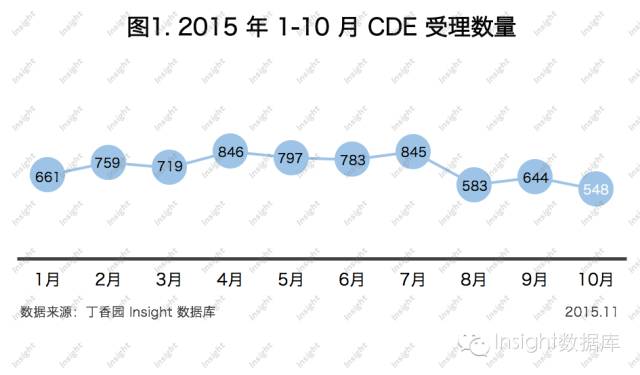
雖然10月申報數量降至全年最低,但因著集中審評,迎來了全年最高完成審評數量,如下圖所示:
以下,分別來分析10月化藥、中藥、生物製品的申報受理及審評審批情況。
10月份CDE共承辦新的化藥注冊申請以受理號計475個,與9月份相比下降了15%。其中各個申請類型的具體數據如下所示: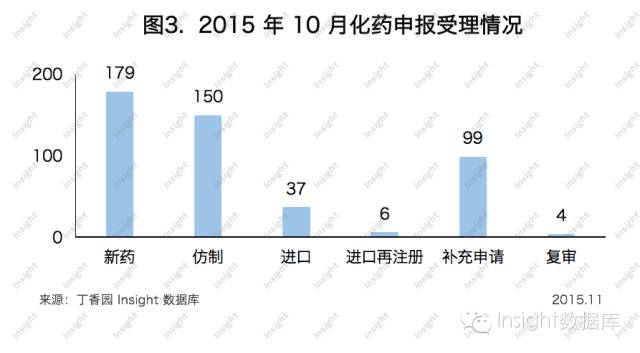
1.新藥
1.1類新藥
四環醫藥再次申報1.1類新藥
根據 Insight數據庫統計,10月份CDE共承辦化藥1.1類新藥申請以受理號計有17個,涉及8個品種,均為臨床申請。具體數據如下所示: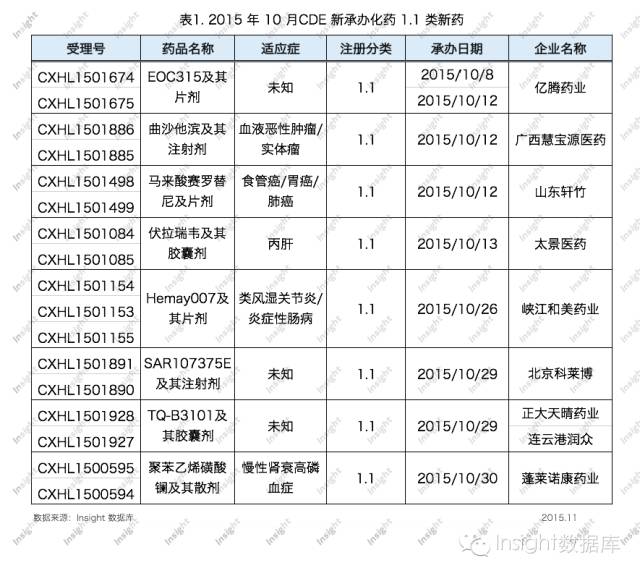
億騰藥業申報的EOC315及其片劑適應症和靶點暫時未知。億騰專注於與外部合作進行新藥研發,其研發線上有7個藥品,但EOC315並不在其列。截至目前,億騰已申報了2個1.1類新藥。
廣西慧寶源醫藥申報了其第一個1.1類新藥曲沙他濱(Troxacitabine),該藥是具有抗腫瘤活性的脫氧核苷類似物,可用於血液惡性腫瘤和實體瘤。曲沙他濱最早由夏爾藥業研發並獨家許可給SGX製藥,但用於急性骨髓性白血病(AML)的臨床試驗因治療證據不足而終止。
四環醫藥集團下的山東軒竹申報了第9個1.1類新藥——馬來酸賽羅替尼,賽羅替尼是新一代不可逆 Pan-HER受體抑製劑,用於治療食管癌、胃癌、肺癌等晚期癌症。
台灣太景醫藥研發股份有限公司控股的太景醫藥研發(北京)有限公司申報了第2個1.1類新藥——伏拉瑞韋,該藥用於治療慢性丙肝,對丙肝六種基因型病毒均有活性。
峽江和美藥業是天津和美生物技術有限公司發起成立的醫藥產業化公司,專注天津和美的1類新藥產業化需求,此次申報的Hemay007是其第2個1.1類新藥,該藥是TNF-α抑製劑,用於治療炎症性腸病、類風濕關節炎等自身免疫性疾病。目前天津和美生物共有包括抗腫瘤、抗炎、心腦血管、中樞等領域在內的21個候選研發藥物在其研發線上,可謂厚積薄發。
北京科萊博研發線上有7個1類新藥,但此次申報的1.1類新藥SAR107375E適應症暫時未知。北京科萊博的前身是國家新藥開發工程技術研究中心,2002年轉為股份製企業。
正大天晴申報的TQ-B3101及膠囊劑已是2015年其申報的第4個1.1類新藥,適應症暫時未知。
另外,蓬萊諾康藥業申報的1.1類新藥聚苯乙烯磺酸鑭用於慢性腎衰的高磷血症,2010年第一次申報臨床,且為特殊審評,但未獲批準。2015年10月該藥第二次申報臨床,卻少了特殊審評這一標簽。
3.1 類新藥
瑞陽、四川百利同時搶仿孤兒藥納呋拉啡
10月份CDE共承辦新的化藥3.1類新藥申請以受理號計有121個,與9月相比申報量小幅下降。
其中,臨床申請有117個,涉及51個品種;上市申請 4個,涉及3個品種。
根據 Insight數據庫的潛力品種篩選係統,篩選出4個在國內首次申報3.1類新藥的品種,它們未來或有可能成為國內首仿。具體數據如下所示: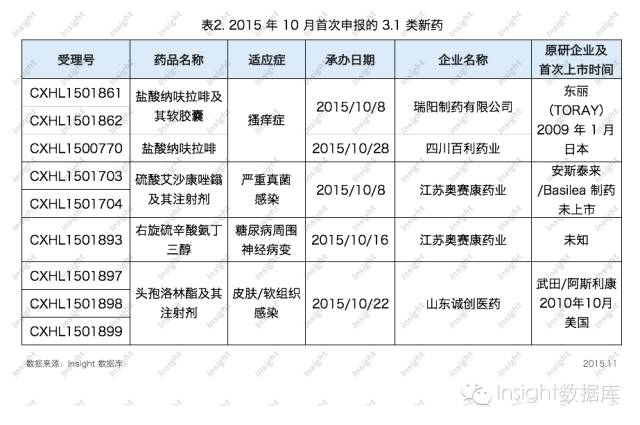
納呋拉啡(nalfurafine)用於治療搔癢症,原研企業為東麗(TORAY)株式會社,已在日本上市,且在歐洲被認定為孤兒藥。原研藥一直未在中國申報,瑞陽製藥和四川百利藥業同時在10月搶仿納呋拉啡,其中四川百利僅申報了原料藥。
江蘇奧賽康10月首家搶仿了兩個藥,一個是安斯泰來和Basilea製藥合作開發的嚴重真菌感染藥物艾沙康唑(savuconazole)注射劑,另一個是右旋硫辛酸氨丁三醇(R-alpha-Lipoic acid tromethamine salt)原料藥及其2類注射劑。
頭孢他諾林(ceftaroline)由武田製藥開發,阿斯利康獲得除美國、加拿大和日本以外的許可權,於2010年8月在中國申報,目前還未申請上市。山東誠創醫藥首家搶仿了該藥,申報藥品名為頭孢洛林酯。
3.進口化藥
賽諾菲提交骨關節炎和幹細胞動員治療藥物上市申請
10月份CDE共承辦新的化藥進口注冊申請以受理號計有37個,其中,臨床申請有27個,上市申請有10個,所有申請共涉及23個品種。
其中,首次在中國申報的進口化藥數據如下所示: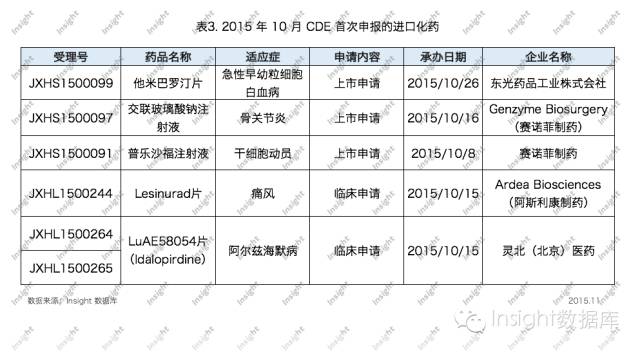
化藥審批情況
1.1類新藥
9個1.1類新藥獲批臨床,大多數為抗腫瘤藥
根據Insight數據庫統計,獲批臨床的1.1類新藥共有9個,涉及21個受理號。
從10月獲批臨床的審評時限來看,屬於重大專項的丁二酸複瑞替尼隻用了7個月就獲得了臨床批件,其他受理則審評了至少1年。
具體數據如下所示:
3.1類新藥
獲批臨床的3.1類新藥占67.96%
根據Insight數據庫統計,10月份CDE完成3.1類新藥審批以受理號計有552個,其中臨床申請487個。
完成審評的3.1類新藥,並非像業內猜測那樣大多數被「槍斃」。據 Insight統計,完成審評的3.1類新藥臨床申請中,批準臨床的受理號有331個,占比為 67.96%,不批準的受理號有11個,僅占2.25%,剩下29.97%的受理號,批準結論暫時未知,但都處於審批中或審批完成狀態。
進口申報中,僅羅氏的ado-trastuzumab emtansine(KADCYLA)為第一次在中國申報臨床,受理號為 JXSL1500059、JXSL1500060。
Ado-trastuzumab emtansine是新一代抗體-藥物共軛物(ADC),靶向作用於HER2, 2013年2月獲FDA批準用於HER2陽性晚期(轉移性)乳腺癌。