
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




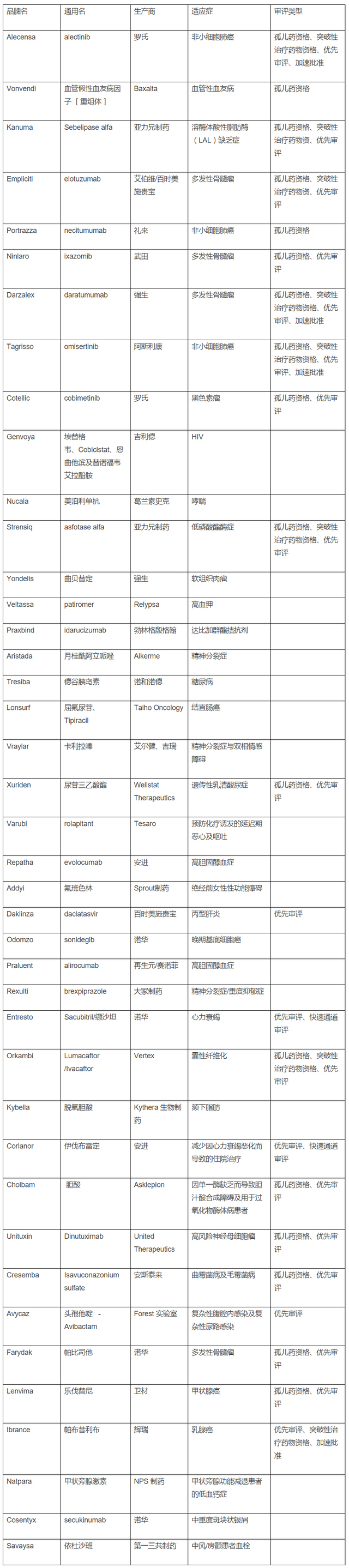
從企業的角度來看,諾華在今年是多產的一年,該公司有四款新藥獲FDA批準,超過了其它任何公司。諾華獲批的四款新藥中,Entresto和Cosentyx有望為這家瑞士公司帶來相當大的銷售額。亞力兄製藥在獲批Kanuma和Strensiq之後,其上市產品的數量增加了兩倍,這標誌著該公司圍繞罕見病治療藥物建立的增長模式將得到一個顯著的進展。
 相關新聞
相關新聞