
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




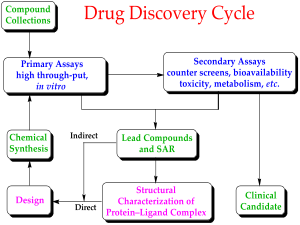
hjc黄金城生物醫藥是一家從事臨床前研究外包服務(CRO)的公司,專門為客戶提供可定製的臨床前試驗服務方案,擁有十餘年研發技術經驗積累,在藥物代謝、藥代動力學、藥效研究,以及毒理學方麵有專業的知識。為您提供高質量的數據和快速的周轉期以支持各項藥物開發、臨床前研究和臨床研究。幫您選取最有價值的候選藥物投入臨床試驗應用階段。hjc黄金城臨床前研究服務有藥物代謝動力學、疾病移植動物模型、藥物安全性評價三大部分組成。涵蓋各個方麵:方案設計、體內研究、樣品分析、專業數據分析、IACUC審查等,以及申報資料準備。hjc黄金城臨床前研究服務簡介
•同位素服務
•蛋白質藥物-藥代動力學研究
•體外利用同位素生物測定
•體內組織分布和排泄研究
| 20,000m2動物實驗房 | |||
| 種屬 | 等級 | 動物房數量新舊對比# | 最大容量(隻) |
| 小鼠,大鼠 | SPF | 66(30) | 5000 |
| 小鼠,大鼠 豚鼠,兔 | Non-SPF | 23(15) | 500 |
| 犬類 | Conventional | 39(22) | 336 |
| 非人靈長類 | Conventional | 32 | 384 |
| 小型豬 | 新增3間小型豬動物房 | ||
電話:02158591500
-------------------備注---------------------
《藥物非臨床研究質量管理規範》(局令第2號)
第六章 研究工作的實施
第二十五條 每項研究均應有專題名稱或代號,並在有關文件資料及實驗記錄中統一
使用該名稱或代號。
第二十六條 實驗中所采集的各種標本應標明專題名稱或代號、動物編號和收集日期。
第二十七條 專題負責人應製定實驗方案,經質量保證部門審查,機構負責人批準後方可執行,批準日期作為實驗的起始日期。接受委托的研究,實驗方案應經委托單位認可。
第二十八條 實驗方案的主要內容如下:
(一)研究專題的名稱或代號及研究目的;
(二)非臨床安全性評價研究機構和委托單位的名稱及地址;
(三)專題負責人和參加實驗的工作人員姓名;
(四)供試品和對照品的名稱、縮寫名、代號、批號、有關理化性質及生物特性;
(五)實驗係統及選擇理由;
(六)實驗動物的種、係、數量、年齡、性別、體重範圍、來源和等級;
(七)實驗動物的識別方法;
(八)實驗動物飼養管理的環境條件;
(九)飼料名稱或代號;
(十)實驗用的溶媒、乳化劑及其它介質;
(十一)供試品和對照品的給藥途徑、方法、劑量、頻率和用藥期限及選擇的理由;
(十二)所用毒性研究指導原則的文件及文獻;
(十三)各種指標的檢測方法和頻率;
(十四)數據統計處理方法;
(十五)實驗資料的保存地點。
第二十九條 研究過程中需要修改實驗方案時,應經質量保證部門審查,機構負責人批準。變更的內容、理由及日期,應記入檔案,並與原實驗方案一起保存。
第三十條 專題負責人全麵負責研究專題的運行管理。參加實驗的工作人員,應嚴格執行實驗方案和相應的標準操作規程,發現異常現象時應及時向專題負責人報告。
第三十一條 所有數據的記錄應做到及時、直接、準確、清楚和不易消除,並應注明記錄日期,記錄者簽名。記錄的數據需要修改時,應保持原記錄清楚可辨,並注明修改的理由及修改日期,修改者簽名。
第三十二條 動物出現非供試品引起的疾病或出現幹擾研究目的的異常情況時,應立即隔離或處死。需要用藥物治療時,應經專題負責人批準,並詳細記錄治療的理由、批準手續、檢查情況、藥物處方、治療日期和結果等。治療措施不得幹擾研究。
第三十三條 研究工作結束後,專題負責人應及時寫出總結報告,簽名或蓋章後交質量保證部門負責人審查和簽署意見,機構負責人批準。批準日期作為實驗結束日期。
第三十四條 總結報告主要內容如下:
(一)研究專題的名稱或代號及研究目的;
(二)非臨床安全性評價研究機構和委托單位的名稱和地址;
(三)研究起止日期;
(四)供試品和對照品的名稱、縮寫名、代號、批號、穩定性、含量、濃度、純度、組分及其它特性;
(五)實驗動物的種、係、數量、年齡、性別、體重範圍、來源、動物合格證號及簽發單位、接收日期和飼養條件;
(六)供試品和對照品的給藥途徑、劑量、方法、頻率和給藥期限;
(七)供試品和對照品的劑量設計依據;
(八)影響研究可靠性和造成研究工作偏離實驗方案的異常情況;
(九)各種指標檢測方法和頻率;
(十)專題負責人與所有參加工作的人員姓名和承擔的工作內容;
(十一)分析數據所采用的統計方法;
(十二)實驗結果和結論;
(十三)原始資料和標本的保存地點。
第三十五條 總結報告經機構負責人簽字後,需要修改或補充時,有關人員應詳細說明修改或補充的內容、理由和日期,經專題負責人認可,並經質量保證部門負責人審查和機構負責人批準。