90家企業164個注冊受理號申請撤回,這是“雙11”以來最大規模的一次撤回。為深入了解不同類型受理號的現狀,筆者對117號文自查品種清單所涉及的受理號進行了跟蹤、統計與分析。
【上篇】五類受理號現狀
11月26日,CFDA發布第255號文(“國家食品藥品監督管理總局關於90家企業撤回164個藥品注冊申請的公告”)。這是“雙11”以來最大規模的一次撤回。
7月22日CFDA發布的第117號文(“國家食品藥品監督管理總局關於開展藥物臨床試驗數據自查核查工作的公告”)中的藥物臨床試驗數據自查核查品種清單中,共涉及1622個產品。那麽,1622自查清單受理號的現狀又是如何呢?為此,筆者進行了統計與分析。
根據8月19日以來CFDA發布的關於藥物臨床試驗數據自查的公告,可將受理號分成5類:申請減免臨床試驗等不需要提交的注冊申請者、8月25日前主動撤回者、8月25日前沒交自查報告也沒撤回者、8月25日前提交自查報告且被發現數據造假者,以及8月25日以後撤回者。
1、 申請減免臨床試驗等不需要提交注冊申請者
8月28日CFDA發布的第169號文(“國家食品藥品監督管理總局關於藥物臨床試驗數據自查情況的公告”)提到,申請減免臨床試驗等不需要提交的注冊申請193個,占12%。筆者認為,目前已獲批生產的有8個受理號,預計也屬於申請減免臨床試驗等不需要提交注冊申請者。
此外,目前已審結完畢的360個受理號,其中317個為8月25日前主動撤回的受理號。對此筆者預測,剩下的43個受理號屬於申請減免臨床試驗等不需要提交注冊申請,且不被批準的可能性較高。
2、 8月25日前主動撤回者
按照相關規定,在8月25日(該日24點關閉自查填報係統)前,申請人自查發現臨床試驗數據存在不真實、不完整的問題,可以主動撤回注冊申請。主動撤回申請的申請人將不予公布。主動撤回的注冊申請317個,占20%。
3、 8月25日前沒交自查報告也沒撤回者
8月25日前沒交自查報告也沒撤回的,則將被視為其臨床試驗數據真實性存疑,對其注冊申請不予批準,並公布該企業和品種名單。申請人既未提交自查資料也未主動撤回的注冊申請有10個。多個申請人共同申報但撤回意見不一致的注冊申請有8個:6個注冊申請相關申請人逾期未提交情況說明,將按撤回注冊申請處理;2個注冊申請相關申請人達成一致意見,提交了情況說明,將保留相關品種注冊申請。
4、8月25日前提交自查報告且被發現數據造假者
8月25日以後未撤回且經核查發現真實性存在問題的,依法立案查處、追究相關人員的責任,向社會公布申請人以及相關責任人名單。
230號文更是提出嚴懲臨床試驗數據造假行為:對已經受理的完成臨床試驗申報生產或進口的藥品注冊申請,申請人已按要求完成自查並報告結果的,將根據審評進度,逐一進行臨床試驗數據核查;發現存在弄虛作假問題的即立案調查,相應注冊申請不予批準。對參與臨床試驗數據弄虛作假的申請人、臨床試驗機構、合同研究組織及其直接責任人,將列入黑名單,向社會公布相關組織機構代碼、人員身份證號碼等信息。涉嫌犯罪的,移交公安機關調查處理。對臨床試驗數據弄虛作假的申請人,自發現之日起,3年內不受理其申報該品種的藥品注冊申請,1年內不受理其所有藥品注冊申請,已經受理的不予批準。藥品監管部門將組織對該申請人此前獲得的藥品批準證明文件進行追溯檢查,發現弄虛作假行為的,撤銷相關藥品批準證明文件,5年內不受理其所有藥品注冊申請。
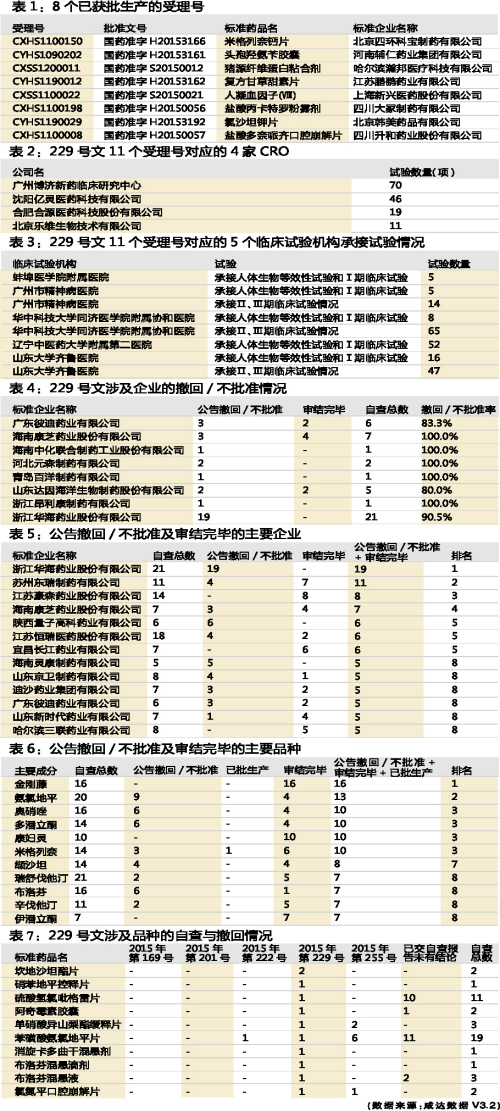
11月11日CFDA發布的229號文,公布了8家企業11個受理號申請的臨床試驗數據存在不真實和不完整的問題,明確這11個受理號注冊申請不予批準。這11個受理號對應4家CRO,共承接自查清單(8月25日之前提交的自查報告清單,共1094份,本段下同)臨床試驗146項;涉及5個臨床試驗機構,承接自查清單Ⅱ、Ⅲ期臨床試驗情況126項,承接自查清單的人體生物等效性試驗和Ⅰ期臨床試驗86項。
按照規定,這些CRO和臨床試驗機構將“連坐”擔責。筆者認為,這是164個藥品受理號集體撤回注冊申請的一個重要原因。還值得關注的是,這些臨床試驗機構原本承擔大量的人體生物等效性試驗和Ⅰ期臨床試驗,此次自查後,這些臨床試驗機構的承接意願將降低,那麽今後藥企尋找臨床試驗基地將會比較困難。
5、8月25日以後撤回者
這種情況將被公布申請人名單。8月25日前申請人提交自查資料的注冊申請為1094個,占67%。10月15日第201號文公布12個受理號注冊申請的相關申請人主動申請撤回。11月6日第222號文公布8家企業提出的10個受理號注冊撤回申請。11月11日公布臨床試驗數據存在不真實和不完整的藥品後,11月26日的第255號文又公布90家企業提出的164個受理號注冊撤回申請。
【下篇】撤回/不批準分析
筆者進一步對近期公告的撤回/不批準情況進行了統計與分析,這也是業內頗為關注的內容。分析中,自查總數是指涉及1622個自查清單品種的受理號總數;公告撤回/不批準數量,是指8月25日之後CFDA公告的撤回/不批準的受理號數量;審結完畢數量包括兩個方麵,一是8月25日前撤回(不公布)的受理號,二是前文提及的“申請減免臨床試驗等不需要提交注冊申請,且不被批準的可能性較高”的43個受理號。
其中,涉及臨床試驗數據存在不真實和不完整的8家企業,共有44個受理號數進入自查名單,目前32個受理號數已被公告撤回/不批準,8個已審結完畢。
公告公示撤回/不批準受理號數量和已審結完畢數量合計最多的企業是浙江華海(SH600521),公告撤回/不批準率高達90.48%。蘇州東瑞4個受理號撤回/不批準,7個受理號已審結完畢,排第二。江蘇豪森57.1%受理號已審結完畢。
產品方麵,金剛藤(合劑、丸劑、分散片、咀嚼片、軟膠囊和口服液)共審結完畢16個受理號,是受理號已有結論(包括公告撤回/不批準、已批生產和審結完畢)數量最多的成分。其次是氨氯地平,已有9個受理號公告撤回/不批準,4個受理號審結完畢。
11月11日第229號文公布不真實和不完整的產品數據後,氯氮平口腔崩解片在11月26日的第255號文再撤回1個受理號數,此產品進入本次自查數據的受理號數基本全部撤回/不批準。類似情況的還有單硝酸異山梨酯緩釋片(撤回2個受理號)和苯磺酸氨氯地平片(撤回6個受理號)。硫酸氫氯吡格雷片和苯磺酸氨氯地平片分別還有10個、11個受理號交了自查報告,但仍未撤回。
結語<<<
綜上所述,目前公告撤回/不批準受理號數量已達212個,公告撤回/不批準率為13.1%。加上此前默默撤回沒被公布的317個受理號,撤回/不批準率為32.6%。若加上43個已審結不獲批可能性較大的受理號,撤回/不批準率達到35.3%。
這是從11月11日至今的半個多月時間內撤回的受理號情況,預計後續還有更多受理號要撤回。坊間傳聞,撤回/不批準率將超過60%。最終結果如何,我們將拭目以待。














 相關新聞
相關新聞