多方博弈:突破中國式研發困境
“有些時候,我們明明坐著最大的雙引擎波音777,但是它延誤一直不飛,我們也沒有辦法。”談及中國藥品創新研發的滯緩,中國醫藥創新促進會執行會長宋瑞霖這樣比喻。的確,與其他新興市場相比,中國在創新投入和產出上都處於領先位置。然而,在醫藥研發創新貢獻的世界排名中,中國卻處於第三梯隊。
從表麵上看,藥物創新隻是個技術和經濟命題,實際上極為複雜。其涉及的利益相關方包括企業、監管機構、醫生、患者等。目前,中國在多項醫藥創新指標中已顯現出強勁的增長勢頭,特別是頂級期刊文章數、藥物專利申請數和在研化合物數量上,但仍有其獨特的創新困境。
【藥企】難!投資回報率日益下降
創新藥研發回報率日益下降是一個全球普遍存在的難題。根據美國藥品研發與製造協會(PhRMA)的數據,包含研發失敗的情形在內,如今一個新藥的平均研發費用已經達到12億美元。與研發成本快速增長的趨勢相比,新藥研發回報率卻已跌至40年以來的最低穀。2013年,百時美施貴寶研發支出經濟回報率為15%,羅氏為7.7%,強生為8.2%,輝瑞為-3.2%,阿斯利康為3.9%,默沙東為3.0%。與此相比,新基醫藥和吉利德相對較高,分別達到32.3%和20.8%。
對於中國原研藥企來說,除了注冊審批耗時長,新藥納入醫保和基藥目錄也比較困難。目前主要自主創新藥都未進入基藥目錄,進入醫保的僅有13隻,其中4隻進入省級醫保。
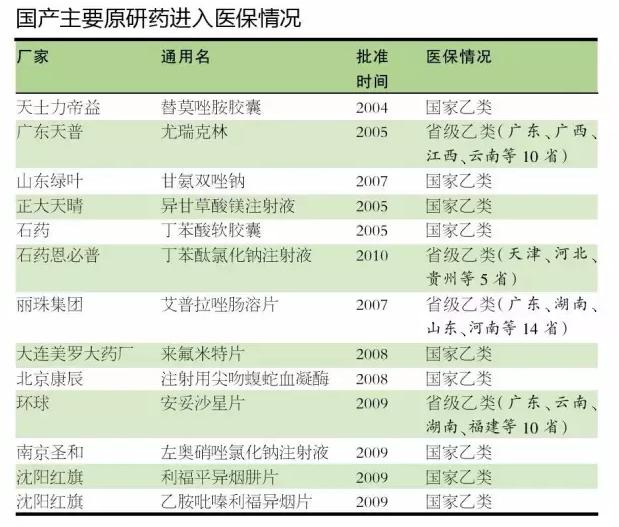
此外,新藥進入臨床治療指南時間也長。非小細胞肺癌美國原研藥ceritinib去年5月31日上市以後,隻花了不到一周的時間就進入《NCCN臨床實踐指南》;而中國新藥埃克替尼竟花了接近3年時間才進入《晚期非小細胞肺癌分子靶向治療專家共識》。

與時間賽跑:結合多層麵營銷手段
“在研發費用越來越高,新藥發現越來越難的背景下,時間要素成為左右新藥利潤產出的鑰匙。新藥在自身生命周期與巨大利潤期待的對峙中艱難掙紮。”上海複星醫藥集團副總裁兼研發中心主任邵穎對記者說。
新藥從研發到獲得醫保投入,德國平均需要12年的回報時間,美國、法國、日本也大多超過10年,而中國則逼近化合物專利保護期的20年。為爭取更高銷量,美國一些原研藥企曾與印度仿製藥企談判,前者支付一定費用以後,後者延緩仿製藥上市時間。
吉利德的Sovaldi堪稱“重磅炸彈”中的傳奇。2014年,Sovaldi為吉利德創造了100億美元的銷售額,戰勝了長居榜首的輝瑞。Sovaldi的價值與利潤傳奇主要歸因於多層麵營銷手段的結合。吉利德從藥物經濟學角度,闡述“擁有較高的治療成本效用的高價Sovaldi,反而能夠為患者節省總體成本”的道理,其不斷公示藥品的高治愈率數據。這些手段是值得國內創新藥企借鑒的。
提高研發效率:精準醫療中國style
美國總統奧巴馬提出的“精準醫療”,是基於個體基因、環境以及生活方式等信息而進行的疾病預防和治療的新興醫療手段。“一旦推廣應用,其將極大提高新藥研發效率,為企業研發節省很多時間,個性化的藥物也將擁有更好的治療效果。”沃森生物副總裁兼研發總監周新華對記者說。
今年3月科技部召開的“國家首次精準醫學戰略專家會議”敲定,在2030年前,中國精準醫療將投入600億元。不久前,衛計委印發《藥物代謝酶和藥物作用靶點基因檢測技術指南》和《腫瘤個體化治療檢測技術指南》兩大指南,指出藥物基因組學已成為指導臨床個體化用藥、評估嚴重藥物不良反應發生風險、指導新藥研發和評價新藥的重要工具;腫瘤個體化治療基因檢測已在臨床廣泛應用,實現腫瘤個體化用藥基因檢測標準化和規範化,是意義重大的緊迫任務。
在業內人士看來,兩大指南將加速精準醫療、基因檢測發展,中國版“精準醫療”正在加速落地兌現。
【政策】支持創新借鑒他山之石
針對現實情況,嚐試專利延長、增補資源、分級管理等
“我國藥物創新發展政策壁壘,主要體現在新藥注冊審批周期、知識產權製度尚待完善、創新藥物市場準入(如招標、醫保等)時間長、對藥物創新的財稅激勵不夠。”宋瑞霖認為,這些因素導致新藥上市後往往銷售增長緩慢。
由於醫保目錄更新較慢,以及集中采購的延遲,中國創新藥品往往上市後幾年都沒有醫保報銷,這已成為關鍵性障礙。
宋瑞霖表示,並非現行政策製定不夠先進,當下的主要問題是政策不配套。
2009年出台的《改革藥品和醫療服務價格形成機製的意見》早已提出對新藥定價引入藥物經濟學評價方法,開放自主定價,並允許創新企業在合理期限內保持較高銷售利潤,也鼓勵醫保經辦機構、醫療機構和藥品供應商進行談判協商確定醫藥費用及付費方式。
化合物的專利保護期為20年,而從化合物發現到臨床試驗結束再到申請上市,一隻新藥平均就已耗時12~15年,缺少符合條件的藥品專利延長的相關製度。盡管允許創新企業保持較高利潤,其藥品上市後所剩的專利保護期已經不多,加上醫保支付障礙嚴重掣肘推廣銷售,限製了新藥的銷售盈利。
在這個方麵,歐美國家規定最多可獲得5年的專利延長期。
應8月18日國務院剛出台的《關於改革藥品醫療器械審評審批製度的意見》要求,藥品審評中心CDE隨即發布《國家食品藥品監督管理總局藥品審評中心審評員管理暫行辦法(試行)》,擬在編製內外增招審評審批技術人員並規範管理(目前藥審中心編製不到200人,遠低於美國的2000人和歐盟的4000人)。除此之外,有專家建議采取分級管理,將重複申報的藥品交由省級藥監部門或區域性審評中心,或能較大幅度降低申報擠壓問題。
【社會】PBM大發展的必要條件
作為第三方因素,PBM有望改變政府與藥企的傳統二元博弈格局
社會這一因素往往被忽視,而其擁有的強大力量可能改變政府與藥企的傳統二元博弈格局。例如,社會輿論壓力可起到倒逼政策的作用,社會融資能激勵創新,一些社會研究機構的衛生技術評估係統可全麵評價新藥的技術特性、臨床安全性、有效性、經濟學特性和社會適應性等,從而起到加快審批進度、為新藥定價提供參考意見的作用。
近十年來,全球醫藥市場以年均10%左右的速度遞增規模,不斷增長的藥品市場需求使各國支付醫療保險費用的負擔逐漸加大。各國政府大多對藥品價格進行了一定的控製,以保證藥品的可負擔性,其中美國采取的就是價格談判方式。
對於藥價的控製,在政府與藥企的博弈中,若引入第三方社會機構,在政府的監管下與企業、醫保機構進行多方談判,在理想的狀態下,對新藥價值的傳遞有提高的作用,進而提高研發效率。
美國PBM運作特點
由於美國商業醫保覆蓋率較高,其醫保製度以自由市場型為主導,於是催生了藥品福利管理公司(PBM)這種控製專利藥品醫保費用的中介角色,在保險機構、製藥公司、醫院和藥房間進行管理協調。
麵對巨大的銷量保證,企業往往願意提供折扣將藥品納入PBM的處方集目錄中;而由於保險機構擁有較為強大的買方力量,往往能以高銷量為籌碼壓低價格,其較低藥價利好必然會吸引更多參保者。
美國PBM巨頭之一快捷藥方(Express Scripts)數據庫擁有大量病人的保單曆史和醫療機構的診療曆史數據,醫院新開具的處方和藥店銷售藥品的記錄實時回傳到數據庫中進行匹配審核,一旦出現藥品錯用或濫用等情況,會立刻進行彈窗提示,以達到費用管控的目的。
中國PBM可行性探討
“他山之石”或能給中國醫保費用控製一點借鑒。然而,中國目前基本醫療製度仍覆蓋廣、浪費大、監管效率低,醫藥分開也處於初級階段,患者購買處方新藥仍依賴於醫生,藥品零售連鎖信息化也才在近兩年剛剛伴隨醫藥電商的推廣而興起。
盡管種種因素對於發展PBM業務不利,但仍有敢於搶先“吃螃蟹”的企業。
海虹控股集團從2009年開始與快捷藥方合作成立PBM公司“益虹”,是國內最早發力該業務的企業。如今其業務試點覆蓋全國18省市約100個地市。有分析師測算,目前杭州地區每年醫保報銷額為100多億元,海虹的PBM係統糾錯率約為6%,僅試點的杭州地區,一年就可減少醫保支付近10億元。
不少業內專家認為,在醫藥分開達到較高程度的時候,PBM模式將得到快速發展。但是,在其能夠成熟運行之前,還有幾個必要條件。
首先,PBM自身應保證有較高的新藥使用評估專業水平;其次,應聯合衛生和藥監機構通過評估新藥有效性、安全性等,建立起符合國情的新藥處方集目錄,為新藥的推廣使用提供一定的保障,引導患者更實惠合理地使用新藥,降低藥企盈利風險。此外,監管機構應加強醫療服務行業的監督,對PBM企業有針對性地製定監督措施,強化立法與執行力度,建立信息公開機製。

分享到:
















 相關新聞
相關新聞