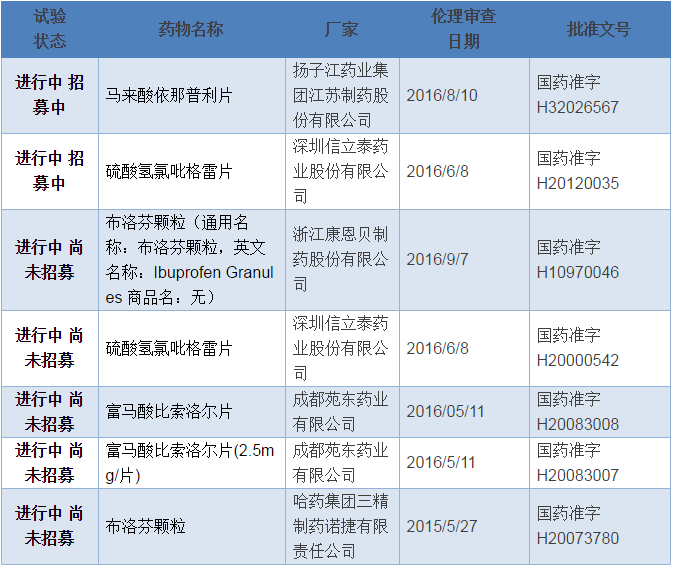
到2016年11月24日為止,在CDE臨床試驗平台備案的CFDA要求的289個品種一致性評價的項目僅有5個藥品,7個廠家規格(文號),如下表。
按照一般的進程,從在 CDE臨床備案到完成人體生物等效試驗需一年左右,也就是說,到2017年底,有望完成SFDA要求的289個基本藥物一致性評價僅有5個藥品,7個廠家規格(文號)。
按照SFDA的要求,這289個藥品的1萬6千多個文號要在2018年前完成一致性評價,目前的進程表明,這不僅注定是一個落空的任務,也是不可能的任務,甚至是在2018年前還基本沒有開始的任務。
影響了一致性評價的關鍵因素有哪些呢?
一、艱難海淘的參比製劑。
到目前為止公布了三批個產品的參比製劑,這些製劑均是在海外注冊生產和銷售,除了購買不同批號外,還要艱苦收集相關合法和合格資質證明,這些與虎謀皮的行為注定了不會得到國外企業的配合,加大了一致性評價的難度,拖延了進程。
然而生產這些製劑的跨國公司在國內設立的中國公司子生產的相同的產品卻不能當做參比製劑,同時,令人感到錯愕的是這些國內子公司在國內地產化的產品在招標時卻被全部當做原研藥品對待享受了原研藥的分組和價格。
這樣兩個環節的不同待遇被指就是一方麵為了加大國內企業一致性評價的難度、一方麵外企可繼續保有市場優勢。而一般原研藥品由國內子公司生產時均是照搬國外的處方或是稍加改進,並不會有實質性變化。
11月22號SFDA公布的仿製藥質量和療效一致性評價工作政策問答中關於參比製劑選擇問題:原研品種難以確定或已停產、退市,美日無相關RLD(reference list drug)產品。
SFDA答:按照《總局關於落實<國務院辦公廳關於開展仿製藥質量和療效一致性評價的意見>有關事項的公告(2016年第106號)》的要求,企業找不到且無法確定參比製劑的,由藥品生產企業開展臨床有效性試驗。
這一條更是匪夷所思,可能是混淆了一致性和有效性的區別,沒有確定參比製劑的開展臨床有效性評價,那麽跟誰做?是和空白對照比有效就可以,還是要有一個參比製劑做非劣效試驗?如果是前者,做有效性試驗那就不是一致性評價,如果是後者還得需要一個參比製劑。
況且臨床試驗相比測定血藥濃度的等效性試驗可變因素太多,要判斷起來要困難的多。
有些參比難道一定要病態的鑽牛角尖式的追蹤到數十乃至百年前的原研藥品廠家?即使追蹤到那個廠家,那麽現在的輔料工藝也不是數十年前當時的藥品的處方和工藝了,隨著時代的進步也不斷更新了設備工藝和處方了。
二、海量的生物等效性試驗需求和緊缺的一期實驗室生物等效試驗能力
從CDE開通臨床試驗備案之日起,在其係統中的等效性備案共543個,計算下來每年接受生物等效試驗不過一二百個,722臨床核查後臨床機構更趨向於少接慎接,除去新藥和注冊的生物等效試驗外,能夠進行一致性評價的寥寥無幾,即使傳說的放寬生物等效試驗機構的認證或放開生物等效試驗的取血,建立起一套能夠經得起核查稽查乃至偵查的質量保證係統到進行試驗至少也得一年以上,對2018前完成一致性評價完全無濟於事,幫不上忙。
三、一致性評價決勝在市場
市場配套的政策才是企業主動進行一致性評價的最大動力,而現在看招標政策並不配套。
從一致性評價概念提出之日,跨國公司就贏定了,因為這從概念上確定了原研藥的優勢地位,原研藥(包含其國內子公司地產化產品)在衛計委的招標規則中單獨分組並不和國內企業比較,拉大了原研和國內企業的價格差,占盡先機國內企業望其項背而不能及。
企業要證明口服製劑的一致性隻有重新進行生物等實驗這華山一條道,以前的上市時的BE試驗數據並不被承認。令人費解的是注射液等進行藥學研究容易被證明一致性的劑型並不開展,也沒有任何渠道得到招標部門的認可。
在招標規則中空有一條通過一致性評價的藥品單獨分組,一直沒有任何一個產品能夠運用這個規則,所以有人認為一致性評價客觀上是幫了原研企業的忙,每年也也多消耗了數百億的醫保費用。一致性評價進展緩慢,外企才是一致性評價中最大贏家。














 相關新聞
相關新聞