序言
“失敗的公司才競爭,成功的公司隻壟斷!”
PayPal創始人,《從0到1》作者:彼得·蒂爾
新藥研發是典型的高科技行業,其“三高”的天然屬性,即高風險、高投入和高回報,決定了新藥研發是技術和資本的高壁壘產業。由於新藥的治療對象是複雜的生命體,與計算機等其他高科技行業不同,其研發效率是“反摩爾定律”。正是由於新藥研發上述特點,所以其上市以後能否獲得絕對的市場優勢是收回投資的重要保障。
正如彼得·蒂爾所說“依靠新的技術創新形成的壟斷不僅在內部完成了良性循環,在外部性上也存在巨大的價值式的企業壟斷”。本文將以美國新藥研發為例,介紹新藥市場獨占保護的主要策略。
新藥背景知識
根據《食品、藥品和化妝品法案》,美國新藥申請(New Drug Application,NDA)主要通過505(b)(1)、505(b)(2)兩種途徑:
505(b)(1):申請人需提供全部安全性和有效性的研究資料,該類申請主要應用於“新分子實體”(New Molecule Entity,NME);
505(b)(2):申請人需提供全部安全性和有效性的研究資料,但部分資料可以引用已公開的數據和資料,該類申請“新化學實體”(New Chemical Entity,NCE)的二次創新,如新適應症、新劑型、新複方等;505(b)(2)不能用於biosimilar的申請。
美國原研藥的保護主要目的是盡可能增加原研藥在市場獨家銷售的時間。根據此目的,製藥公司在新藥保護上主要采取兩個基本策略:1)縮短新藥審批過程,加速新藥上市速度;2)推遲仿製藥上市,延長新藥上市後的獨占期。為了更好的激勵製藥公司開發新藥的動力,美國國會和FDA製定了眾多法案和製度。
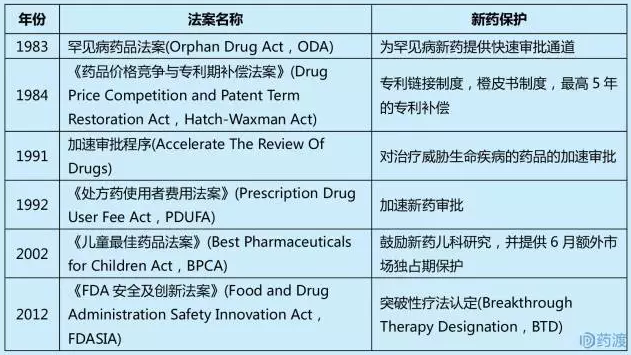
縱觀美國對新藥的激勵和保護政策,原研公司主要通過行政保護策略和專利保護策略最大化保護新藥,以期獲取豐厚收益。
行政保護策略
FDA為了鼓勵新藥研發,製定了係列行政手段,主要包括新藥特殊審評策略和數據獨占保護策略,來加快新藥審批,保護新藥市場獨占。
3.1 新藥特殊審評策略
新藥上市審評模式可分為標準審評模式和特殊審評模式兩大類。大多數創新藥物通過標準審評模式上市,一般FDA標準審評需要10-12月;特殊審評模式主要適用於重病、罕見病、兒童用藥或有突破性療效的藥物,特殊審評一般6個月,同時其還能有效縮短原研藥臨床試驗周期。特殊審評能夠縮短新藥審評審批過程,進而延長新藥在專利期內市場獨占。具體包括有優先審評(priority review) 、加速審批(accelerate approval)、快速通道(fast track)和突破性療法(breakthrough therapy)4種模式:
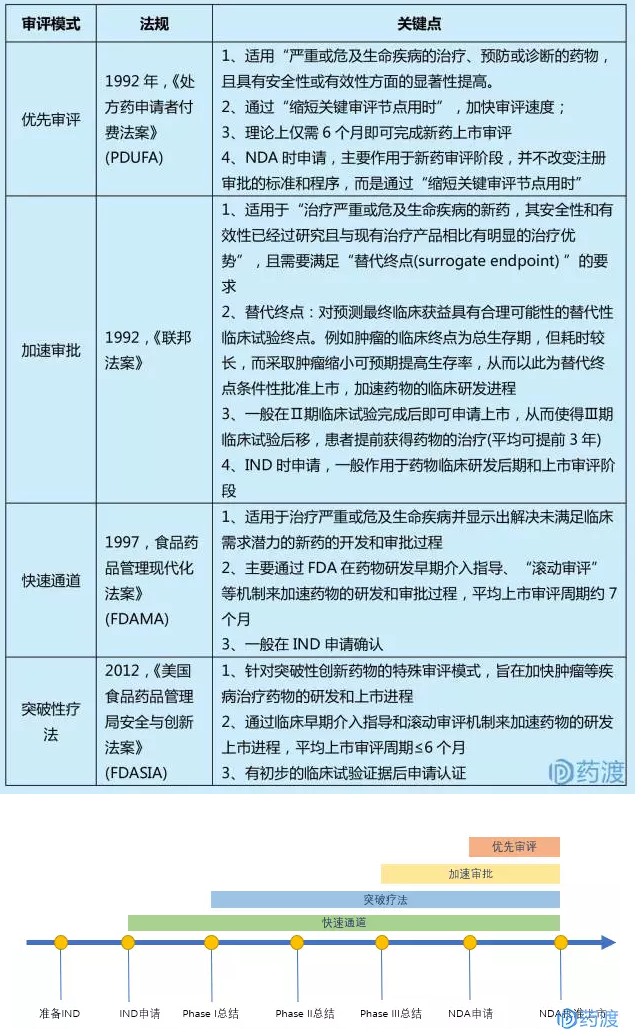
圖:各特殊審評模式作用區間示意圖
製藥公司可以充分利用上述四種新藥特殊審評製度,縮短新藥研發周期,加快新藥上市銷售,最大化利用新藥專利賦予的市場獨占。在實踐過程中,製藥公司可以聯合利用不同新藥特殊審評模式,即一個藥物同時獲得多種特殊審評模式資格認證,進一步加快藥物的研發及上市進程。
3.2 數據獨占(Data Exclusivity)保護策略
藥品試驗數據主要是指在新藥開發的不同階段所取得的實驗數據,包括臨床前數據和臨床試驗數據。數據獨占,指在一定期限的時間內未經數據持有人同意,FDA不允許仿製藥廠使用原創藥的各類試驗數據,用以證明藥品安全性和有效性的仿製藥上市申請。數據獨占權由藥品批準上市之日起算,無論藥品有無申請專利或專利是否有效,均不影響藥品獲批上市後自動享有的數據獨占權。藥品數據保護製度是一種行政性的知識產權保護製度,各國藥品監管部門往往采取“不受理”或“不批準”仿製藥的申請。FDA關於新藥數據保護的市場獨占期主要分為以下類型:

專利保護期是一種相對保護,專利保護存在被挑戰的可能,專利保護期間仿製藥仍可上市;數據獨占保護期是一種絕對保護,通過在保護期采取“不受理”或“不批準”仿製藥申請的行政措施,設置了仿製藥上市準入門檻,保證了創新藥物絕對市場獨占狀態,保障上市後創新藥物能及時收回巨額研發成本。
專利保護策略
專利保護是指專利藥品的專利權人在專利保護期限內有權禁止他人製造、使用、許諾銷售、銷售或者進口其專利藥品。專利保護策略包括專利叢林策略,專利長青策略,專利延長策略等。
4.1 專利叢林策略(Patent Tricket)
專利叢林指的是相互交織在一起的知識產權組成密集的網絡,一個公司需要艱難穿過這個網絡才能把新技術商業化。製藥行業的專利一般分為基本專利和外圍專利。製藥公司可以通過專利叢林戰略,圍繞該專利藥從多個角度著手,申請一係列的專利,編織一個多角度、多層次、寬範圍的專利網,從而最大限度地保護藥物權利,以期獲取更多的利潤。一個基礎的新藥化合物專利申請專利保護的路線大致如下:通式結構的基本化合物(NCE)專利和具體結構化合物專利,以及衍生的外圍專利,包括製備方法專利、中間體專利、組合物專利、製劑專利、用途專利等。立普妥在FDA橙皮書上登記情況如下表所示:
另外,原研藥公司還會申請眾多其他外圍專利,但這些專利並不登記在橙皮書上,進一步加大了仿製藥公司的仿製難度。原研藥公司通過專利叢林策略,提高專利壁壘,延長新藥的市場獨占期。
4.2 專利長青策略(Evergreening of Patent)
專利常青(又稱patent evergreen)是指:專利權人通過在已有專利基礎上策略性地提交專利申請,利用專利法及相關法規延長專利壟斷權的行為。專利常青中“常青”二字體現了原研藥企的市場競爭策略,其並非指某個專利申請行為,而是指基於同一藥品的一係列組合專利申請。原研藥企針對已知藥物開發新用途、新劑型等,來延長新藥的市場獨占期。以艾爾建的眼用藥物ALPHAGAN為例:

ALPHAGAN(含0.15%酒石酸溴莫尼定)橙皮書登記專利
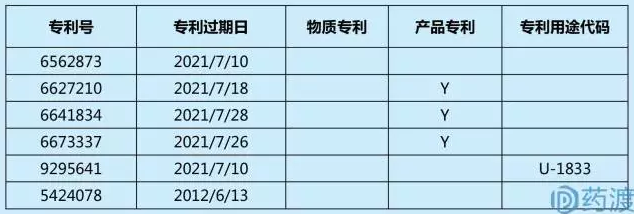
ALPHAGAN(含0.1%酒石酸溴莫尼定)橙皮書登記專利

COMBIGAN(含0.2%酒石酸溴莫尼定和0.5%馬來酸噻嗎洛爾)橙皮書專利登記

1996年,FDA首次批準以溴莫尼定為NCE的ALPHAGAN,到2007年批準的含有溴莫尼定和噻嗎洛爾組合物的COMBIGAN;這11年,ALPHAGAN從沒有任何專利保護逐漸發展壯大成一個包括四個產品的係列藥物,產品專利保護期延長至2023年。這個過程中,艾爾建陸續布局了16個專利來保護這些產品。
4.3 專利延長策略
專利延長製度是對原研藥因臨床試驗、FDA審評或由於PTO審查延誤等所損耗的專利期予以一定補償的製度。該製度通過適度延長原研藥的專利獨占期,讓原研藥公司能夠在新藥上市後獲得豐厚的收益,進而充分調動製藥公司開發新藥的動力。專利延長製度主要分為PET製度





















 相關新聞
相關新聞