豁免來由
體內生物等效性BE的研究是證明製劑之間治療等效性的一種手段,主要通過測量血藥濃度來判斷藥效是否等效。BCS的概念在提出之前,申請者一般是很難有一個科學的理論作為依據向相關的監管部門提出豁免BE;今年來,隨著BCS概念的不斷提出和不斷論證,越來越多的監管機構開始考慮並接受基於BCS的生物等效性豁免,如FDA、EMEA、WHO。
BCS全稱為biopharmaceutics classification systm,國內一般譯為“生物藥劑學分類係統”,是根據藥物在水中的溶解度和腸壁滲透能力對藥物進行科學分類的標準。對於口服固體速釋製劑而言,原料藥的溶解性、滲透性和製劑的溶出度對這3個方麵基本決定了藥物在體內的吸收速度和程度:BCS I:高溶解性 & 高滲透性;BCS II:低溶解性 & 高滲透性;BCS III:高溶解性 & 低滲透性;BCS IV:低溶解性 & 低滲透性。
如果體外研究能充分證明體內性能無差異,那麽可豁免體內生物等效性的研究。對於BCS I類藥物而言,如忽略製劑中輔料的影響,通常可免除體內生物等效性研究;BCSIII類藥物在體內吸收的限速步驟是藥物的吸收,如藥物在體內能迅速釋放,並能在到達藥物吸收部位時達到飽和濃度,則可以忽略不同製劑釋放速率的差異。因此,目前寄希望更多於BCS I和BCS III藥物的豁免。
西咪替丁基本介紹
西咪替丁屬於組胺H2受體拮抗劑,長期用於治療十二指腸潰瘍、胃潰瘍及卓-艾綜合征。西咪替丁於1971年被發現,1977年開始被商業化使用,原研公司為GSK(但2002年均撤市),已有較長的使用曆史。
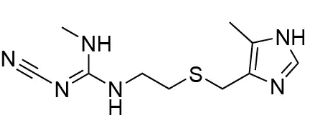
西咪替丁化學結構式
BCS分類:在pH1-8的介質中(37度),西咪替丁的溶解度均能達到6mg/ml;市售最大規格為0.8g (CFDA批準的最大規格為0.2g),即約用133ml水即能將其溶解(小於250ml),所以西咪替丁歸屬為具有高溶解性;通過對健康受試者測試,西咪替丁在體內的絕對生物利用度約為60%(低於85%),故將其歸屬為低滲透性。根據BCS分類概念,西咪替丁屬於BCS III類藥物。
安全性:西咪替丁屬於治療窗寬的藥物,健康成年人腎功能正常時半衰期(t1/2)約為2小時。關於西咪替丁的副作用比較少,被報道的有腹瀉、皮疹、頭昏眼花、疲勞、便秘、肌肉痛等,這些現象通常都比較輕微、發作時間也比較短。總的來說,幾乎沒有什麽副作用引起重大臨床事件。西咪替丁的血藥濃度可通過反相HPLC有效檢測。
自研與原研在體內外的差異
西咪替丁片的原研公司為GSK,1977年獲得FDA批準的NDA,商品名為TAGAMET®,批準規格為200mg、300mg、400mg、800mg;同時還獲得鹽酸西咪替丁注射劑的NDA,活性成分為鹽酸西咪替丁,批準規格為300mg/2ml。
方案設計:在自研處方中,在保持片重不變(1000mg)的情況下,通過調整處方中尤特奇Eudragit(緩釋材料)與葡萄糖的比例來刻意造成體外溶出曲線的巨大差異,最終與原研製劑產品進行體內PK比較。
自研處方與原研的體外行為
以西咪替丁片400mg為例,每片中含有西咪替丁400mg。體外溶出曲線的差異主要通過尤特奇Eudragit RS PO控製;三個體外溶出有明顯差異的成品最終在健康受試者體內進行相對生物利用度的研究。
自研產品均采用直壓工藝,所有的原輔料經過篩後混合後采用單衝壓片機壓製。各項檢測指標如片重差異、硬度、含量均勻度均符合現行的藥典要求。
溶出條件:①0.01N HCl介質,pH約為2.0;②pH 4.5的磷酸鹽緩衝液;③不含酶的人工腸液(藥典配製方法),pH約為6.8;④FaSSIF(空腹狀態下模擬腸液),pH約為6.5,其中,第一、二、三種介質的選擇是根據BCS豁免指南指定介質來的,第四種介質FaSSIF模擬液是基於膽鹽的考慮而額外增加的。溶出介質500ml,槳法75rpm。將自研的三個製劑與原研製劑Tagamet-400mg分別在這四種介質進行溶出速率測試,分別測定它們在不同pH條件下的溶出曲線;同時,通過溶出曲線突出自研三個製劑的體外差異。最終均將其與原研數據比較並計算差異因子f1和相似因子f2。
取樣點為15min、30min、60min、90min、120min、180min、240min、300min、360min
從上述曲線中可看出:
原研製劑在上述四種介質中15min溶出均低於85%,30min則高於85%;
三個處方和原研製劑分別在四種不同pH介質中呈現的溶出曲線是相似的,說明在它們在胃腸道的上段的環境中具有相似的溶出趨勢;
7.5% Eudragit(處方1)在四種介質中30min內溶出達到85%,差異因子f1均符合相似性要求(<15),但相似因子f2有的介質符合要求,有的介質不符合要求(≥50),因此,從體外溶出曲線上看,處方1與原研處於相似的邊緣;
15% Eudragit(處方2)在四種介質中在120min處溶出才接近85%,而26% Eudragit(處方3)在360min處溶出才接近80%;
處方2和處方3與原研製劑對比的f1和f2均不滿足相似性的要求,且均是在30min後溶出才達到85%。
因此,從體外溶出上看,似乎處方1勉強能與原研相似,處方2和處方3則不能稱與原研相似。
自研處方與原研的體內行為
方案設計:征集12個健康的誌願者(其中2個為候補)采用單劑量給藥、5種方式的Williams設計方法。誌願者樣本數量是根據文獻報道數據然後在PS網站(PS:Power and Sample Size )中計算而來的,平均年齡21.7歲 (20 - 24歲),平均體重59.5kg (52.5 - 67.5kg)。所有誌願者在空腹過夜後(不超過10小時)首次給藥,或者服用400mg的片劑、或者被注射300mg/2ml的原研注射劑。服用片劑的誌願者在服藥後服用一玻璃杯水(約250ml),四小時後服用標準餐。服用片劑的誌願者,在0min(服藥前)、30min、60min、75min、90min、105min、120min、150min、180min、210min、240min、360min、480min、600min和720min處分別收集血液5ml;而對於處方2和處方3的製劑,還需在960min和1444min處收集血液。注射劑誌願者注射藥物後在0min(服藥前)、10min、20min、30min、45min、60min、75min、90min、120min、150min、180min、210min、240min、360min和480min處分別收集血液。試驗符合《赫爾辛基宣言》要求。
借助軟件,通過血藥濃度評估以下PK參數:
AUC12:0到12小時血藥濃度-時間曲線下的麵積;
AUCo (ug h/ml):0到無窮大時間血藥濃度-時間曲線下的麵積;
F (%):絕對生物利用度;
Cmax (ug/ml):血藥最大濃度;
MRT (h):mean residence time,平均滯留時間。
試驗結果
下圖為分別為通過服用片劑(左圖)和注射注射劑誌願者(右圖)的血藥濃度-時間的曲線圖:
注:每個點代表12個誌願者血藥濃度的平均值
從上圖左圖中可看出,所有片劑處方在口服12小時的吸收情況即可反應藥物在體內的整個吸收情況,雖然處方2和處方3還有取樣點960min (16h)和1440min (24h),但12小時後的血藥濃度量均太低,低於色譜條件的檢測下限。因此可忽略。從左圖還可發現,處方3 (26% Eudragit)有三峰現象,而已有報道稱西咪替丁吸收會有雙峰或多峰;但處方3的Cmax顯著慢於其它處方,吸收曲線與其它處方有較大差異。
通過IVIVC分析發現,除了處方3 (26% Eudragit)外,其它處方均表現為藥物滲透性是體內吸的限製因素;而處方3呈現的是線性關係(R2=0.9685),見下圖:
因此,本案例可間接說明,隻有當西咪替丁體外溶出120min內未達到85%,才會影響到體內的吸收速率,即西咪替丁120min內體外溶出達到85%則不會影響到體內吸收。
計算機模擬分析
Yasuhiro Tsume and Gordon L. Amidon在2010年借助Gastroplus模擬分析了部分藥物的體外溶出與體內吸收的情況,下圖為西咪替丁的模擬結果:
作者主要考察溶出達到85%時所需的溶出時間。上圖的每個數據是基於24個虛擬試驗的平均值而獲得的(即假設受試者24例),其中,黑色框框表示預測具有生物等效性,紅色則表示體內不等效。通過模擬可發現,藥物體外溶出60min內達到85%,體內基本上是等效的;而在空腹時,胃排空時間一般為15-60min。
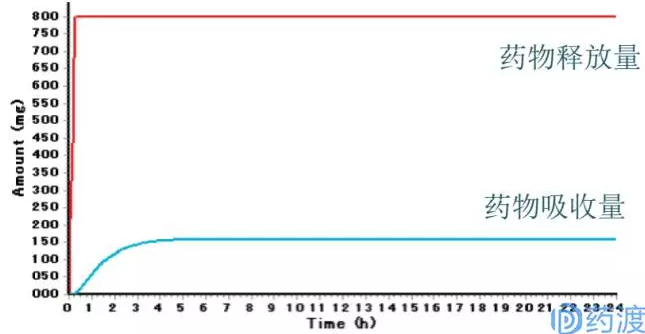
下圖為模擬西咪替丁體外溶出在15min達到85%時體內藥物吸收情況,其中,紅色線條代表體外藥物釋放量-時間的曲線;藍色線條代表體內藥物吸收量-時間的曲線。
上圖中,可明顯看出當西咪替丁體外溶出度在不到1小時即達到平台期,其體內吸收仍需3~4小時才完全吸收完,因此,限製西咪替丁體內吸收的關鍵因素為其較差的滲透性,而非體外的溶出速度。
小結
假如藥物中的輔料既不會影響胃腸道上段的蠕動,也不會影響活性成分的體內吸收,且藥物在所有生理pH條件下均具能快速溶出,那麽,這些BCS III藥物在體內具有相似的行為。事實上,目前已有多個BCS III類藥物被報道其體外溶出不一致但體內一致,因此它們被推薦為豁免藥物的候選者,但似乎很少有研究能直接證明當藥物溶出多慢時才會影響到這些III類藥物的吸收,而非僅僅局限於“15min內達到85%”這個“極快速溶出”條件。
本研究所用的輔料均為FDA批準的輔料及對應的用量(IID中可查詢),通過外在條件製造西咪替丁體外極快速溶出(處方1)和體外緩慢溶出(處方3)證明了西咪替丁在體外溶出120min未達到85%(處方2的限)才會影響體內吸收。因此,若不考慮輔料的影響,西咪替丁速釋製劑獲得豁免的可能性非常大;我們隻需要的輔料的選擇上多加小心。
國內情況
2017年07月21日,CFDA發布的仿製藥參比製劑目錄(第八批)通告指出,西咪替丁片的參比製劑如下:
CFDA網站顯示,共有388個西咪替丁單方片劑產品和213個西咪替丁單方膠囊產品獲得CFDA的批準。根據藥智數據統計,目前有10條參比製劑備案信息,涉及企業7家,均為單方片劑,具體見下表:
主要參考資料:
1.Feasibility of Biowaiver Extension to Biopharmaceutics Classification System Class III Drug Products Cimetidine
2.The Biowaiver Extension for BCS Class III Drugs: The Effect of Dissolution Rate on the Bioequivalence of BCS ClassIII Immediate-Release Drugs Predicted by Computer Simulation
3.Clinical pharmacokinetics of cimetidine
4.FDA、WHO和EMA關於基於生物藥劑學分類係統的生物等效性豁免指導原則的比較
5.人體生物等效性試驗豁免指導原則





















 相關新聞
相關新聞