
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




|
公告時間 |
批次 |
自查公告號 |
受理號數 |
|
2015年7月22日 |
第一批自查 |
2015年第117號 |
1622 |
|
2016年4月1日 |
第二批自查 |
2016年第81號 |
181 |
|
2016年8月30日 |
第三批自查 |
2016年第142號 |
82 |
|
2016年11月1日 |
第四批自查 |
2016年第171號 |
55 |
|
2016年12月30日 |
第五批自查 |
2016年第202號 |
14 |
|
公告名 |
第一批自查 |
第二批自查 |
第三批自查 |
第四批自查 |
總計 |
|
藥物臨床試驗數據現場核查計劃公告(第1號) |
16 |
-- |
-- |
-- |
16 |
|
藥物臨床試驗數據現場核查計劃公告(第2號) |
20 |
-- |
-- |
-- |
20 |
|
藥物臨床試驗數據現場核查計劃公告(第3號) |
1 |
-- |
-- |
-- |
1 |
|
藥物臨床試驗數據現場核查計劃公告(第4號) |
31 |
1 |
-- |
-- |
32 |
|
藥物臨床試驗數據現場核查計劃公告(第5號) |
13 |
23 |
-- |
-- |
36 |
|
藥物臨床試驗數據現場核查計劃公告(第6號) |
23 |
1 |
6 |
-- |
30 |
|
藥物臨床試驗數據現場核查計劃公告(第7號) |
34 |
4 |
12 |
-- |
50 |
|
藥物臨床試驗數據現場核查計劃公告(第8號) |
21 |
1 |
1 |
7 |
30 |
|
藥物臨床試驗數據現場核查計劃公告(第9號) |
23 |
2 |
1 |
5 |
31 |
|
合計 |
182 |
32 |
20 |
12 |
246 |
|
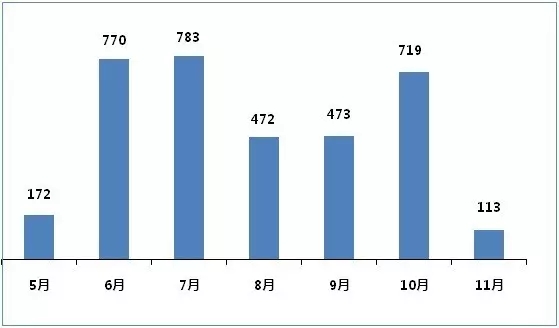
月份 |
5月 |
6月 |
7月 |
8月 |
9月 |
10月 |
11月 |
總計 |
|
備案 |
164 |
752 |
650 |
413 |
391 |
646 |
109 |
3125 |
|
申報 |
8 |
18 |
117 |
55 |
62 |
70 |
4 |
334 |
|
推薦 |
-- |
-- |
16 |
4 |
20 |
3 |
-- |
43 |
|
總計 |
172 |
770 |
783 |
472 |
473 |
719 |
113 |
3502 |
|
產品名 |
289目錄 |
非289目錄 |
總計 |
|
阿莫西林膠囊 |
82 |
14 |
96 |
|
辛伐他汀片 |
54 |
8 |
62 |
|
奧美拉唑腸溶膠囊 |
58 |
4 |
62 |
|
頭孢氨苄膠囊 |
52 |
3 |
55 |
|
苯磺酸氨氯地平片 |
50 |
3 |
53 |
|
鹽酸二甲雙胍片 |
49 |
1 |
50 |
|
鹽酸雷尼替丁膠囊 |
42 |
-- |
42 |
|
頭孢拉定膠囊 |
41 |
-- |
41 |
|
異煙肼片 |
36 |
-- |
36 |
|
阿奇黴素片 |
28 |
7 |
35 |
|
總計 |
492 |
40 |
532 |
|
推薦單位 |
7月 |
8月 |
9月 |
10月 |
總計 |
|
河南省醫藥行業協會 |
-- |
-- |
-- |
1 |
1 |
|
河南普瑞製藥有限公司 |
-- |
-- |
-- |
1 |
1 |
|
西雙版納版納藥業有限責任公司 |
-- |
-- |
-- |
1 |
1 |
|
浙江省醫藥行業協會 |
16 |
3 |
-- |
-- |
19 |
|
中國生化製藥工業協會 |
-- |
1 |
-- |
-- |
1 |
|
中國化學製藥工業協會 |
-- |
-- |
20 |
-- |
20 |
|
總計 |
16 |
4 |
20 |
3 |
43 |
 相關新聞
相關新聞