在絕大數藥物靶點中酶學靶點是一個大類。本文主要以酶催化的基本化學反應原理為起點,概述和闡述下酶催化反應的幾個基本概念Km,Kcat和Ki,以及其測定方法,分析下一個靈敏的酶學篩選方法開發的幾個關鍵步驟,概括論述下酶抑製劑的類型以及在實驗檢測過程中不同類型酶抑製劑的IC50和Ki之間的關聯。
酶是生命體內化學反應的催化劑,能夠在生理溫度和常壓下加快化學反應的速度,幾乎所有的細胞活動進程都需要酶的參與以提高效率。特定酶活性或者表達量的增強或者缺少都有可能導致生命活動的異常,疾病的發生。在藥物研發過程中酶是十分重要的靶點,也是十分有潛力和效果的靶點,如最近在中國上市的吉利德的慢性丙型肝炎新藥索華迪(索磷布韋),其效果和價格一樣讓人印象深刻,一個療程6萬人民幣左右,對於基因1,2,3,6型HCV具有抗病毒活性,治愈率高達92%-100%,其作用的靶點是NS5B RNA聚合酶;又如晚期大腸癌的一線用藥是伊立替康,其代謝活性成分SN-38是DNA拓撲異構酶Ⅰ抑製劑,其與拓撲異構酶Ⅰ及DNA形成的複合物能引起DNA單鏈斷裂,阻止DNA複製及抑製RNA合成,為細胞周期S期特異性。首款獲得FDA批準的雙藥HIV療法新藥Juluca,其兩個活性成分,Dolutegravir是HIV-1整合酶鏈轉移抑製劑(integrase strand transfer inhibitor,INSTI);Rilpivirine是一款非核苷逆轉錄酶抑製劑(non-nucleoside reverse transcriptase inhibitor,NNRTI)。酶作為一個很有潛力的靶點,如何建立一個簡單高通量的酶學抑製物的篩選方法是這篇文章筆者主要討論的問題。我們可以重溫一下酶學基本的反應原理開始酶催化反應原理
絕大多數酶學反應都可以用下圖簡單的模型進行描述:
E代表酶,S代表底物,P代表催化產物。ES代表在催化反應開始前形成的中間態產物酶-底物複合物,E和S形成ES複合物的反應是可逆反應的過程,k1是E和S形成ES複合物的結合速率常數,相當於配體受體結合時的Kon或者Ka, k-1是ES解離形成E和S的解離速率常數,相當於配體受體結合時的Koff或者Kd(關於以上概念可參考筆者前期的文章--生物功能學篩選評價技術之親和力評價篇);ES解離形成E和P的過程在反應初期一般認為是不可逆的過程,反應產物E會被反應體係中的過量的S捕捉,k2是ES形成E和P的速率常數,也被稱之為Kcat,相當於配體受體結合時的Kon或者Ka酶催化效率:
一個酶相對於其底物的催化效率主要由兩個方麵決定Kcat/Km, Km值(米氏常數)越小, Kcat值越大,催化效率越高。Km值的化學本質是E和S可逆反應過程中的解離平衡常數KD,反映的是E和S親和力的強弱,Km值越小親和力越強,效率越高。Kcat值是ES解離形成E和P的速率常數。Km值和Kcat值測定
米氏方程描述了在穩態反應條件下酶催化反應中初始反應速度V和底物濃度 [S]的相關關係:
當V等於1/2的 Vmax時,底物濃度 [S]為Km值。
在實際的檢測過程主要包括以下幾個步驟:
1. 少量固定濃度的酶(nM或者pM級別),梯度濃度稀釋的底物(底物濃度相對於酶濃度由遠遠過量,mM到μM)進行分組,酶催化反應;
2. 每個分組對酶催化反應的產物進行動力學檢測(酶標儀進行熒光,吸光度檢測或者HPLC檢測),選取各分組信號時間的線性反應區域進行V計算;
3. 選取梯度濃度稀釋的底物動力學檢測的線性區域的斜率作為初始反應速度V進行數據米氏方程擬合,擬合圖形的平台期為Vmax, 1/2的Vmax時V對應的底物濃度值是Km值。處理結果示意圖如下:
4. 當酶催化反應達到最大速度時,S遠遠大於E,所以所有的E均被S捕獲,E和S的逆反應速度可忽略不計,[ES]=[E]
Vmax=[ES]*Kcat=[E] *Kcat,所以Kcat= Vmax/[E]
以上是Km和Kcat的測定和計算過程,值得注意的是在實際的實驗過程中需要注意以下幾點:
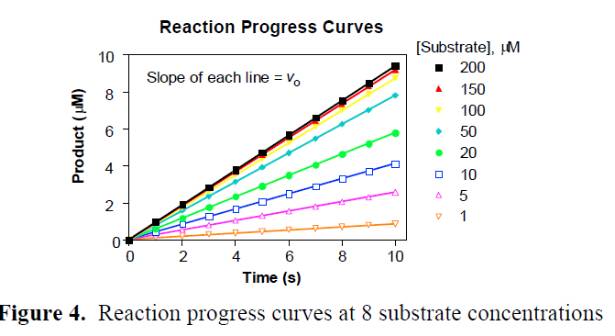
1.必須是動力學讀數,選取初始反映的線性段的斜率作為初始反應的速度。終點法讀數的結果很多時候並不可靠,應為酶催化反應隨著時間的進行底物的消耗,反應速度會從勻速到非均速變化,如果采用終點法可能得到不真實的初始速度,如下圖:
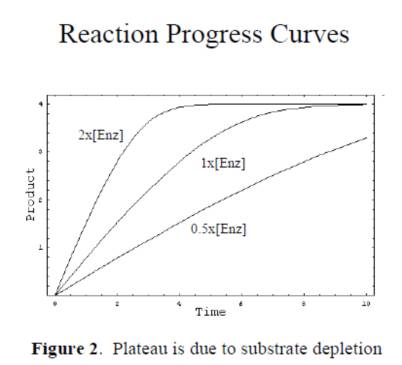
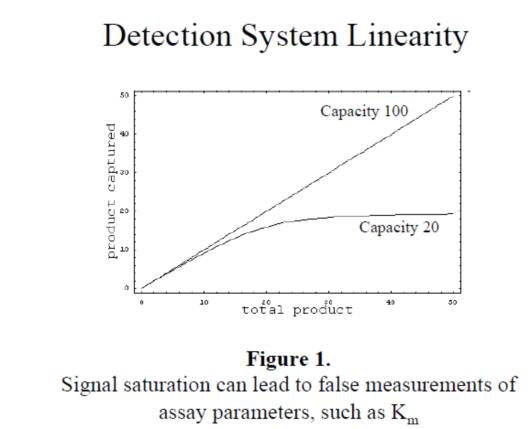
2. 必須確認儀器的檢測線性,當酶催化反應,產物的量過多時,超過儀器檢測的線性區域時,檢測的產物的量不準,影響到後續參數的計算,如下圖:
酶學藥物篩選模型的建立
酶學篩選方法的幾個核心參數包括酶,反應環境,底物和抑製物。一般來講反應環境需要查閱文獻進行調研,確定PH值,離子強度,洗滌劑等對酶活的影響,底物可以根據酶催化原理選擇天然底物,也可以選擇合成底物(底物的選擇和後續配套的檢測方法緊密相關)。一個酶學方法的開發可能涉及到以下一些因素:
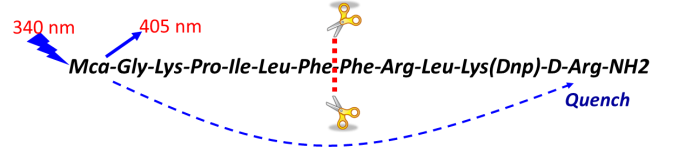
底物的選擇和配套的檢測方式,如下圖某蛋白水解酶,其識別的位點是氨基酸線性表位,可以人工合成多肽,在其N端和C端分別加入熒光基團和淬滅基團,正常狀態下或者酶活抑製狀態,該多肽在酶標儀340nm激發時,其發射光會被淬滅基團吸收,在405nm無信號產生;酶催化反應會將該多肽剪切,當酶標儀340nm激發時,405nm有信號產生。
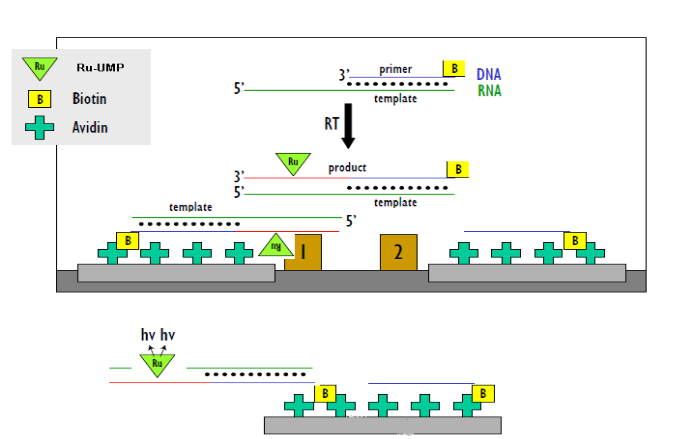
又如某病毒逆轉錄酶,合成RNA模板和對應引物,在其引物上進行生物素標記,其中堿基上進行Ru標記,隨著酶催化的逆轉錄反應的進行,引物上不斷有Ru標記堿基上去形成核苷酸序列,通過親和素的板子捕捉引物,檢測Ru信號值來評判酶的催化和抑製的活性。
酶,底物濃度的選擇和反應時間的選擇
當酶對應的底物確定以後,選取少量的酶濃度(pM或者nM)對底物進行Km測定,選取底物的Km濃度作為篩選的反應濃度,選取該濃度下線性的反應時間內的某個時間點作為反應終止或者檢測的時間。酶和梯度稀釋的化合物進行預孵育後,加入Km濃度的底物,反應一段時間後進行檢測,這個就是一般酶學篩選模型。
酶抑製劑機理研究
對於靶點酶的抑製劑,主要可以歸納為三類(competitive競爭性, noncompetitive非競爭性, uncompetitive不競爭性)
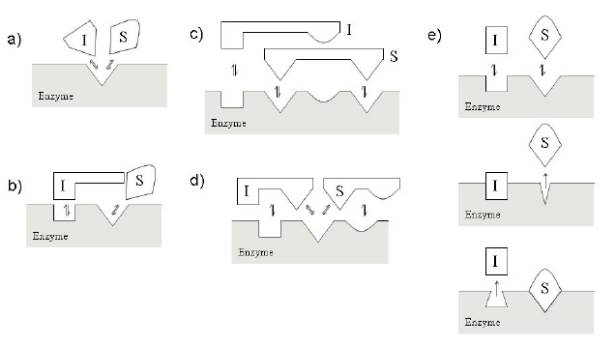
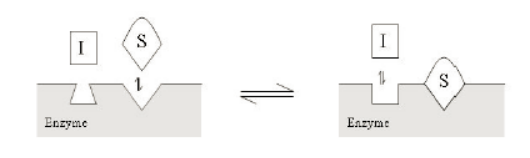
competitive競爭性抑製劑隻和自由的酶結合,通常情況下和底物共同競爭結合位點(活性中心),當然也有競爭性抑製劑和底物互斥的情況出現,兩個中隻有一個能夠和自由的酶結合。在競爭性抑製劑存在的情況下,酶相對於底物的Km和Vmax測定時,測得得表觀Km值增加,Vmax值不變,如下圖所示,幾種競爭性抑製劑的圖示:
noncompetitive非競爭性抑製劑
非競爭性抑製劑可以和自由的酶結合,也可以和酶-底物複合物結合,抑製劑結合的位點和活性中心位點不在相同的表位,最終也會導致酶催化活性的喪失。在非競爭性抑製劑存在的情況下,酶相對於底物的Km和Vmax測定時,測得得表觀Km值不變,Vmax值降低,如下圖所示:
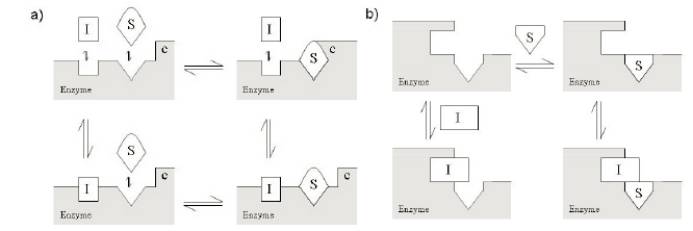
uncompetitive不競爭性抑製劑
不競爭性抑製劑隻和酶-底物複合物結合,形成失活的抑製劑-酶-底物複合物。酶相對於底物的Km和Vmax測定時,測得得表觀Km值降低,Vmax值降低。如下圖所示:
不同類型抑製劑Ki和IC50之間的關聯
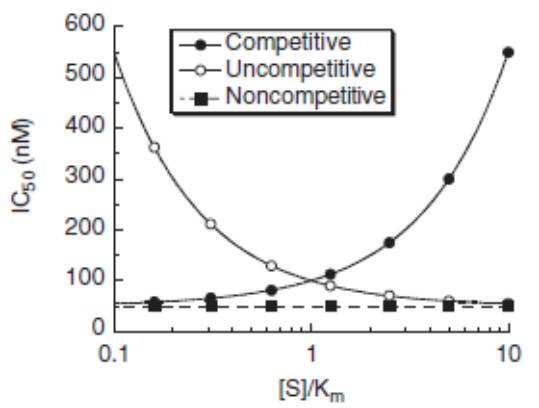
Ki描述的是抑製劑和酶的結合強弱,是抑製劑和酶的解離平衡常數,是個狀態函數,不會受到反應體係中底物濃度的影響,不同實驗得到的Ki值具有可比性;而IC50則是在特定酶學檢測方法中酶活抑製一半時抑製劑的濃度,根據不同類型的抑製劑,底物濃度可能對IC50產生影響,不同實驗得到的IC50值不具可比性。根據不同類型的抑製劑,在理想條件下(酶濃度遠遠小於底物濃度進行反應),Ki和IC50的關係如下:

不同抑製劑類型IC50和反應體係中加入的底物濃度的關係示意圖如下:
展望:
絕大多數生命活動的調控均是有酶的參與,對酶的選擇性抑製可以調控細胞的增殖、分化、凋亡以及免疫調節等許多重要的生物學過程,如JAK抑製劑,IDO抑製劑等在臨床研究或者市場上證明了其價值或者潛在的價值。了解酶學反應的化學原理,搭建合適的酶學篩選模型;表征酶抑製劑的不同抑製機理,也有助於細微區分不同抑製機理藥物可能起到的差異性的臨床獲益。
利用酶催化反應進行體外的功能學檢測也是常用的工具,如ELISA中HRP酶的催化顯色,細胞活性檢測時琥珀酸脫氫酶催化的CCK8檢測,報告基因檢測過程中luciferase酶催化的化學發光等,了解其化學原理和動力學反應進程有助於功能學方法學開發,優化檢測方法的條件。
酶催化反應是理解體外生物功能學評價體係承上啟下的一環,此反應過程描述了是從Binding(affinity)轉換到function(potency)的過程,且在理想條件下此過程是線性傳遞的,即產物生成量是ES的量和Kcat的乘積,Vp=[ES]*Kcat。與之相對的,蛋白相互作用過程中,隻有Binding(affinity),大部分受體介導的細胞學效應既有Binding(affinity),也有function(potency),但是由Binding(affinity)到function(potency)之間的傳遞往往是非線性的,每種細胞由於其細胞內環境蛋白的表達差異性會導致由胞外結合引起的刺激非均一放大形成差異性效用。下一篇筆者將會對更為複雜的細胞學相關測定方法進行討論。
參考資料
《Guidance for Assay Development & HTS》
SECTION V: ENZYMATIC ASSAYS
SECTION XII: MECHANISM OF ACTION ASSAYSFOR ENZYMES














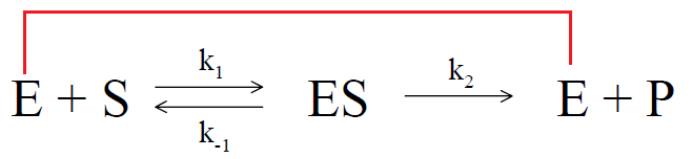
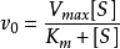









 相關新聞
相關新聞