創新推動社會進步。創新藥的開發就是這樣,每個新療法的問世都意味著患者有了新的治療選擇,公眾健康又可能向前邁一大步。在2017年第一季度,美國FDA共批準了12種新藥。與2016年第一季度的6款新藥相比,足足翻了一番。今日,我們我們也對這12款新藥進行總結和盤點,供大家參考。
1.Trulance(plecanatide)
開發者:Synergy公司
適應症:慢性特發性便秘(Chronic Idiopathic Constipation,CIC)
批準日期:1月19日
CIC是一種複雜的功能性胃腸道疾病,其症狀包括每周少於三次的排便和不通暢的排便習慣。患者除了有腹部腹脹和不適等身體症狀外,多伴有心情壓力和焦慮。
Trulance是首個模擬體內尿鳥苷素蛋白(uroguanylin)功能的新型藥物。尿鳥苷素為一種天然存在的內源性胃腸道蛋白肽,可以刺激流體分泌,並通過影響常規腸功能,改變糞便的稠度。
2. Parsabiv(etelcalcetide)
開發者:安進(Amgen)
適應症:繼發性甲狀旁腺功能亢進症(HPT)
批準日期:2月8日
繼發性甲狀旁腺功能亢進(HPT)是一種慢性嚴重疾病,影響全世界範圍200多萬接受透析的大部分病人,在美國就有46.8萬人。繼發性HPT是指甲狀旁腺響應腎功能下降和礦物質代謝受損,而過度分泌甲狀旁腺激素(PTH)。PTH水平升高可導致從骨組織大量流失鈣和磷酸鹽。由於繼發性HPT通常最初不顯示症狀,它常常被診斷不足和治療不足。大約88%的血液透析CKD患者會發生繼發性HPT。
Parsabiv是12年來首個被批準用於治療這種疾病的療法,也是血液透析療程結束時,由透析醫療護理人員每周三次靜脈注射的唯一鈣劑。Parsabiv是一種新穎的擬鈣劑,用於治療血液透析成人CKD病人的繼發性HPT。擬鈣劑是一類通過激活甲狀旁腺上的鈣敏感受體而模擬鈣作用的藥物。Parsabiv結合並激活甲狀旁腺上的鈣敏感受體,從而降低PTH水平。
3. Emflaza(deflazacort)
開發者:Marathon Pharmaceuticals
適應症:杜氏肌營養不良症
批準日期:2月9日
杜氏肌營養不良症是肌營養不良症最常見的類型。由於缺乏對肌纖維功能至關重要的dystrophin蛋白,患者的肌細胞無法保持完整,導致病變。據統計,全球平均每3600個新生男嬰中,就有一人罹患此病。該疾病的症狀通常會在三五歲時出現,並逐漸惡化。到青少年時期,患者會由於肌肉的無力或萎縮,導致行走能力逐漸喪失。到20-30多歲,患者往往會出現足以威脅生命的心髒和呼吸係統疾病症狀。
Emflaza是首個經美國FDA批準,用來治療杜氏肌營養不良症的皮質類固醇藥物。在這之前,它曾獲得了FDA頒發的優先審評資格、快速通道資格、以及孤兒藥資格。在全球,這類激素是常見的杜氏肌營養不良症治療手段。
4. Siliq(brodalumab)
開發者:Valeant Pharmaceuticals
適應症:中度至重度斑塊性銀屑病
批準日期:2月15日
銀屑病(俗稱牛皮癬)是一種導致皮膚發紅和剝落的皮膚疾病,而且它是一種自身免疫性疾病,在患有該疾病家族史的患者中更常見,多發病於15歲至35歲之間的人群之中。銀屑病的最常見形式是斑塊型銀屑病,患者的主要表現為界限清楚的淡紅或紫褐斑塊,硬幣至手掌大小,數目不定,上覆蓋有細薄鱗屑。
Siliq的活性成分brodalumab是抗IL-17受體的單克隆抗體,可抑製在斑塊狀銀屑病發展中起作用、由IL-17引起的炎症反應。
5. Xermelo(telotristat ethyl)
開發者:Lexicon Pharmaceutical
適應症:類癌綜合征腹瀉
批準日期:2月28日
▲Telotristat ethyl分子結構(圖片來源:MedKoo)
類癌綜合征是一類發生於不到10%類癌瘤患者身上的衰弱性病症,通常是在腫瘤擴散到肝髒之後出現。這些腫瘤是罕見的,並且通常緩慢生長。大多數的類癌瘤存在於胃腸道中,會分泌過量的激素血清素,可導致腹瀉及多種並發症,包括體重減輕、營養不良、脫水和電解質失衡等。
Xermelo可靶向抑製類癌瘤細胞內介導過量血清素生成的色氨酸羥化酶,以降低發生腹瀉的頻率。Xermelo被批準可與生長抑素類似物(SSA)聯用,以治療在接受SSA療法後病情未得到充分控製的類癌綜合征腹瀉患者。
6. Kisqali(ribociclib)
開發者:諾華(Novartis)
適應症:絕經後女性的HR+/HER2-晚期或轉移性乳腺癌
批準日期:3月13日
▲Ribociclib的分子式(圖片來源:維基百科)
Kisqali是CDK4/6激酶的抑製劑,被FDA批準與芳香酶抑製劑聯合作為初始內分泌類治療方案,用於絕經後激素受體陽性、人類表皮生長因子受體-2陰性(HR+/HER2-)的晚期或轉移性乳腺癌女性患者。在這之前,Kisqali已獲得突破性療法認定和優先審評資格。
7. Xadago(safinamide)
開發者:Newron Pharmaceuticals
適應症:帕金森病
批準日期:3月21日
目前,左旋多巴是治療帕金森病最有效的藥物,患者群體中服用該藥物的比例高達75%。然而,長期使用這款藥物可能會導致嚴重衰弱的運動能力波動。這種波動分為兩種階段——在“開啟”期,患者的運動能力一切正常;而在“關閉”期,患者的運動能力會出現明顯下降,甚至連行走都困難。因此,隨著疾病的發展,這些患者需要額外的藥物來應對和管理由於服用左旋多巴而產生的運動能力波動。
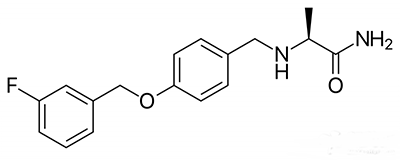
▲Safinamide分子結構(圖片來源:維基百科)
Safinamide正是一款能應對“關閉”期的藥物,能選擇性抑製MAO-B。作為一種單胺氧化酶(monoamine oxidase),MAO-B會降解多巴胺,而多巴胺能夠在腦區傳遞信號,對於流暢的自主運動非常重要。因此,safinamide有望能避免多巴胺被MAO-B降解。通過這一作用機製,研究人員希望safinamide能緩解帕金森病患者在“關閉”期的運動能力下降。
值得一提的是,這也是美國FDA在十多年來首個獲批用於治療帕金森病的新化學實體(New Chemical Entity)。
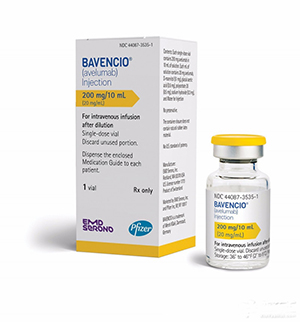
8. Bavencio(avelumab)
開發者:默克(Merck KGaA)和輝瑞(Pfizer)
適應症:轉移性默克爾細胞癌(mMCC)
批準日期:3月23日
Bavencio(avelumab注射液,20mg/mL)可用於12歲及以上兒科和成人轉移性默克爾細胞癌的治療。這是全球首個獲批治療轉移性默克爾細胞癌的抗PD-1/PD-L1免疫療法,也是全球第二款獲批的抗PD-L1單克隆抗體。之前,avelumab已獲得了美國FDA的突破性藥物資格、快速通道地位、孤兒藥地位和優先審查資格。
9. Symproic(naldemedine)
開發者:Shionogi 和Purdue Pharma
適應症:阿片類藥物引起的便秘
批準日期:3月23日
▲Naldemedine分子結構(圖片來源:維基百科)
此次批準的Symproic® 0.2mg片劑C-II為一天口服一次,其活性成分naldemedine是阿片受體拮抗劑,可治療慢性非癌性疼痛成人患者由於使用阿片類藥物而引起的便秘。
10. Zejula(niraparib)
開發者:TESARO
適應症:複發性上皮卵巢癌、輸卵管癌或原發性腹膜癌
批準日期:3月27日
Niraparib是一種PARP抑製劑,能阻斷參與修複受損DNA的PARP酶活性。對帶有BRCA基因突變的癌細胞來說,倘若PARP活性進一步受到抑製,這些細胞分裂時就會累積大量DNA損傷,導致癌細胞死亡,或是減緩腫瘤生長。
相比於其他PARP抑製劑藥物,niraparib十分獨特——它是首款無需檢查BRCA突變或其他生物標誌物的狀況,就能在臨床上顯著改善複發性卵巢癌患者的無進展生存期的PARP抑製劑。此外,它僅需每日口服一次,就能起到控製病情的效果。因此,這是一種非常易用的維持療法。先前,它曾獲得美國FDA頒發的快速通道資格、突破性療法認定以及優先審評資格。
11. Dupixent(dupilumab)
開發者:賽諾菲(Sanofi)
適應症:中度至重度濕疹(特應性皮炎)
批準日期:3月28日
Dupixent的活性成分dupilumab是一種人源化的單克隆抗體,被設計用於特異性抑製白細胞介素-4(IL-4)和白細胞介素-13(IL-13)的過度信號傳導,這兩種關鍵性蛋白分子被認為是特應性皮炎病理中持續性炎症的主要驅動因素。Dupilumab預裝於注射器中,可以在初始加載劑量後隔周一次皮下注射自體給藥。
Dupixent適用於經局部治療仍不能充分控製的濕疹,或那些不適合使用局部治療的病人;Dupixent可以單獨使用或與局部皮質類固醇同時施用。Dupixent是首個獲批針對上述適應症的靶向生物藥劑。
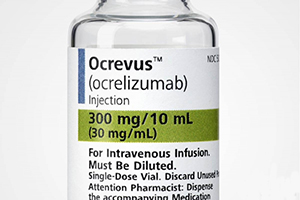
12.Ocrevus(ocrelizumab)
開發者:羅氏(Roche)
適應症:複發性及原發性進展型多發性硬化症
批準日期:3月28日
多發性硬化症(MS)是一種中樞神經係統的慢性炎症疾病,目前尚無治愈方案。當自身免疫係統異常地攻擊大腦、脊髓和視神經神經細胞周圍的絕緣和支撐組織(髓鞘)時,引起炎症和隨之而來的損傷,於是引發了MS。複發緩解型MS(RRMS)是該疾病的最常見形式,其特征在於患者經曆一段時間的恢複期後,他們複發新的或惡化的體征或症狀。大約85%的MS患者最初被診斷為RRMS。原發性進展型MS(PPMS)是MS疾病的一種衰弱形式,其症狀不斷惡化,雖然通常沒有明顯的複發或緩解期,但卻是多發性硬化症中致殘率最高的一類。大約有15%的MS患者被診斷為該疾病的原發性進展型形式。
Ocrevus(ocrelizumab)是一種人源化單克隆抗體,被設計用於選擇性靶向CD20陽性B細胞。這一特定類型的免疫細胞被認為是造成髓磷脂(有絕緣和支持神經細胞功能)和軸突(也就是神經細胞)損傷的關鍵性因素;而這類神經細胞損傷可導致MS患者的殘疾。基於臨床前研究結果,OCREVUS結合到某些表達CD20表麵蛋白的B細胞上,但不結合幹細胞或漿細胞,因此也保護了免疫係統的重要功能。
參考資料:
[1] Novel Drug Approvals for 2017
[2] FDA官方網站




















 相關新聞
相關新聞