4月28日,CFDA官網發布第三、第四批仿製藥參比製劑目錄,共涉及32個品種60個品規。
目前企業開展仿製藥一致性評價的進度如何?下文通過備案參比製劑企業數超過30個的產品2017年生物等效性試驗開展情況來進行分析。
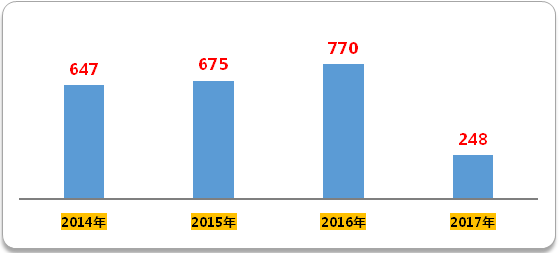
分析CDE藥物臨床試驗登記與信息公示平台顯示的數據可知,2016年臨床試驗登記號為770個,是三年來的新高。鹹達數據V3.2發現,2017年前四個月(截至2017年4月25日,下同),臨床試驗登記號數達到248個,基本與往年持平。然而,從2015年CFDA共批準4573個受理號,2016年批準3666個受理號臨床來看,批量獲批臨床的這些受理號,之後上臨床的依然不多。
圖1 2014年至今臨床試驗登記號
(數據來源:鹹達數據V3.2)
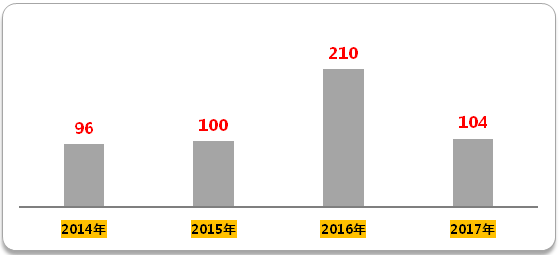
生物等效性(BE)試驗方麵,2016年開展的試驗登記號210個,是2015年的兩倍。2017年前四個月BE登記號數就已經104個,超越2015年全年。由此可見,臨床申報積壓解決之後,臨床試驗的競爭也隨之開始。
2017年開展的104個生物等效性試驗臨床登記號中,有45個來自BE備案。這意味著備案製的執行,讓後來申報者與此前積壓排隊申報者同時站在了一個時間起跑線上,鑒於此前積壓排隊的申報者未必按一致性評價要求完成項目,從而在申報生產競爭中處於劣勢。
圖2 2014年至今生物等效性試驗登記號
(數據來源:鹹達數據V3.2)
多數BE未啟動,接盤謹慎
備案企業數超過30家的11個產品中,有8個未開展BE
鹹達數據V3.2通過了解備案參比製劑企業數超過30個的產品2017年生物等效性試驗開展情況來分析目前一致性評價的進度。
阿莫西林膠囊
阿莫西林膠囊是最多企業備案參比製劑的產品,超過50家企業對其進行備案。2017年終於有3家企業開展生物等效性試驗,分別是桂林南藥股份有限公司、石藥集團中諾藥業(石家莊)有限公司和珠海聯邦製藥股份有限公司中山分公司。這3家都是通過BE備案申報開展的,目前進度都是招募中。
奧美拉唑腸溶膠囊
作為2018年年底必須完成一致性評價289個品種之一,奧美拉唑腸溶膠囊有近50家企業對其進行備案,但是暫無企業開展生物等效性試驗。
鹽酸二甲雙胍片
鹽酸二甲雙胍片也是289個品種之一,也有近50家企業對其進行備案。2016年石藥集團歐意藥業有限公司已開展生物等效性試驗,目前試驗已完成。2017年北京四環製藥有限公司通過BE備案開展試驗,目前進度招募中。
鹽酸雷尼替丁膠囊
鹽酸雷尼替丁膠囊共48家企業對其備案,也屬於289個品種之一,目前也無企業對其開展生物等效性試驗。
辛伐他汀片、甲硝唑片
辛伐他汀片和甲硝唑片都在289品種名單之中,都有近40家企業對其進行備案,都沒企業在2015年以後開展生物等效性試驗。
苯磺酸氨氯地平片
超過30家企業備案苯磺酸氨氯地平片。2015年10月,北京天衡藥物研究院南陽天衡製藥廠開展苯磺酸氨氯地平片生物等效性試驗,目前進度為“已完成”。2016年,長春海悅藥業有限公司、揚子江藥業集團上海海尼藥業有限公司和西安葛藍新通製藥有限公司3家開展生物等效性試驗,其中揚子江藥業集團上海海尼藥業有限公司是BE備案。2017年,僅江蘇黃河藥業股份有限公司1家通過BE備案開展生物等效性試驗。以上2016年以後開展的試驗目前進度未有超過招募階段的。
頭孢拉定膠囊、頭孢氨苄膠囊、阿奇黴素片和諾氟沙星膠囊
289品種名單之中的頭孢拉定膠囊、頭孢氨苄膠囊、阿奇黴素片和諾氟沙星膠囊,都有超過30家企業備案,都暫未有企業開展生物等效性試驗。
從表1所示,阿莫西林膠囊、鹽酸二甲雙胍片和苯磺酸氨氯地平片試驗開展的醫院中,首都醫科大學附屬北京地壇醫院和上海市徐匯區中心醫院分別以2個項目排第一,其中上海市徐匯區中心醫院同時接收1個產品不同企業的項目。
表1 阿莫西林膠囊、鹽酸二甲雙胍片和苯磺酸氨氯地平片
(數據來源:鹹達數據V3.2)
小結
參比製劑備案企業數超過30家的產品共11個,隻有3個產品在2015年以後有企業開展生物等效性試驗,未開展的8個產品都在289目錄名單中。由此可以推測,289品種目前一致性評價的進度大多數還沒進入臨床階段。
2015年和2016年獲批的項目中,有不少是科技公司的仿製藥項目。MAH製度後,在試點城市的科技公司可以自行啟動項目,大多數項目最終還是要和生產企業合作。臨床項目啟動數量較少,從側麵來看反應了BE臨床試驗成本上升後,下遊企業投資趨謹慎。最終能啟動的項目都是實力較強以往信譽度較高的科技公司名下的。
BE備案項目對應的臨床機構
主要集中在北、上、江、吉,個別機構承接項目較多
2016年以後,鹹達數據V3.2發現,通過BE備案進行生物等效性臨床試驗的登記號共70個,其中齊魯製藥有限公司的產品數最多,共三個,分別為奧氮平口崩片、利培酮口崩片和鹽酸特比萘芬片。
70個BE備案產品主要在38個臨床機構中開展試驗,其中吉林大學第一醫院是最受歡迎的醫院,共7個廠家產品在其開展生物等效性試驗。長春中醫藥大學附屬醫院排第二,共4個廠家產品在其開展生物等效性試驗。上海市徐匯區中心醫院、無錫市人民醫院和中南大學湘雅三醫院並列第三。
進一步分析發現,2016年以後吉林大學第一醫院開展的生物等效性試驗的登記號48個,長春中醫藥大學附屬醫院13個,上海市徐匯區中心醫院7個,無錫市人民醫院6個,中南大學湘雅三醫院8個。
小結
從臨床機構而言,承接的臨床機構主要分布在北京、上海、江蘇、吉林,仿製藥批文號較多的廣東承接的臨床機構較少。個別臨床機構承接的項目數較多。
表2 70個備案BE對應的臨床機構
(數據來源:鹹達數據V3.2)
仿製藥參比製劑目錄(第三批)
仿製藥參比製劑目錄(第四批)


















 相關新聞
相關新聞