全球製藥市場持續變化,最主要的表現在於仿製藥的市場份額和數量持續上升。當前,全球研發支出增長趨緩,監管日趨嚴格,使用者付費不斷增加,產業整合再度升溫,生產商應該如何應對這些問題?本文通過分析製藥行業成功的增長模型及案例,探討專業信息如何幫助企業快速而有效地向更高價值的產品和服務轉化?以及正在經曆變革的行業和企業,他們新的、不同以往的戰略需要哪些信息來滿足不斷變化的需求?
目前,全球每年用於提供國民醫療保障的藥費超過1萬億美元。預計到2018年,這筆花費將以平均每年5.5%速度遞增,但是不同區域增速有明顯不同。多數歐洲市場的增速小於2%,而很多亞洲、中東、拉美和非洲國家的增速將超過8%。
現在,全球仿製藥市場規模約為4350億美元,預計到2017年,市場份額將增長至36%。雖然仿製藥已達到很高的市場滲透率,歐洲為50-60%,亞洲為45-50%,美國接近80%,但是預期仍有很大的增長空間。盡管如此,仿製藥費用的增長預計將與全球醫療保障費用的增速保持一致,在北美、日本和歐洲成熟市場將呈個位數增長,在中國、巴西和印度等國家,增長率可達10-20%。
全球製藥市場正在持續變化,其中最關鍵的一點就是,未來某個時間,仿製藥行業將從這個變化中持續獲益。2016年至2019年,將有超過1000億美元的品牌藥專利到期麵臨仿製藥的競爭。
仿製藥持續增長的原因是多方麵的,既為生產企業創造了機會,也同時帶來了風險。比如,政府、公共機構和私有醫療保險公司都將很大程度繼續依賴仿製藥以控製患者的醫療保險費用,這也為行業的長期發展創造了機會。但同時,這些機構最常做的是減少預算和資源,加上招標時采取的“價低者勝出”的做法給生產商帶來很大壓力,要求生產商不斷降低價格的同時,還要保證質量、安全性、有效性或供應的可靠性;其最終的結果往往是產品供應和利潤持續下滑。
與此同時,生產商還不得不與其他各種複雜的挑戰做鬥爭。由於監管日趨嚴格,則提高了供應鏈追蹤和溯源的要求,以及新的、不斷增加的仿製藥費用支付,這些都使各國市場為確保合規而增加成本。美國FDA仿製藥審批過程中有4000多件ANDA積壓,預計批準時間為40個月。預計至少在未來五年,全球領先的創新型公司研發費用將保持每年約750億美元不變,這意味著未來8-10年內,將不會有大量新藥獲批上市,仿製藥的機會將減少。另一方麵,越來越多的CMC開發外包和或大或小的創新型公司原料藥和製劑生產外包,也為定製合成與CRAMs(定製研發和生產服務)公司創造了新的機會。最後,在很多國家中,生物藥占已上市藥物超過40%,同時占臨床開發階段在研藥物的37%。隨著監管通路的日趨成熟以及各利益相關方對生物類似藥的接受,不論生產商是否希望參與競爭,他們都必須對生物類似藥有一個清晰的戰略。
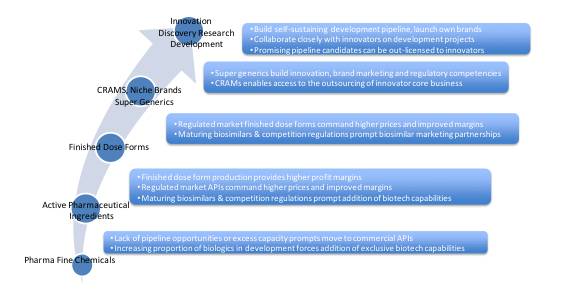
在解決以上問題和挑戰之前,公司的商務戰略團隊圍繞行業可行性模式的思考是有價值的。這些思考既可以作為評估一家公司當前定位和能力的衡量標準,也可以作為明確接下來去哪,需要哪些商業能力來達成預期並進行決策的工具,同時還需了解支持這些變化所需的信息。圖1所示的行業增長模式可以用來幫助評估與決策。
印度Jubilant Life Sciences是一個很好的案例,展現了如何將自身有機增長與兼並購結合起來,從上世紀70年代的一家小型吡啶化工廠成長為現在年收入數十億美元的全球化生命科學公司。這個轉變需要將複雜的中間體和原料藥,與專科藥物和生物類似藥整合在一起。在這個過程中,該公司花費了7.5億美元用於在本國及歐洲、美國和加拿大開展收購交易。
讓我們來看一下,為了加強地位或者進入任何其他領域以實現增長,CMO公司或者專業合成公司所需考慮的關鍵戰略決策:
本土、區域或全球市場拓展
開發新的技術平台,拓展技術能力
從小分子項目向生物藥項目轉變
擴大產能或擴展產品管線
從在研合成項目向仿製藥原料藥轉變,反之亦然
在降低成本,增加效能、質量、安全性或供應鏈保障方麵投資
取代或收購競爭對手,獲取新的能力
啟動整合:收購進入原料藥生產或者CRAMS 領域
同樣,仿製藥經銷商或者生產商所需要考慮的增長策略:
本土、區域性或全球市場拓展
生產更加複雜的劑型,擴大產能和產品管線
從非藥政市場轉向藥政市場
向內向外授權許可,以驅動市場拓展
收購並推廣競爭小、有品牌的、利基藥或者專科藥
生產、銷售或者合作銷售生物類似藥
在美國發起“Paragraph IV”專利挑戰
與創新型公司合作,上市授權仿製藥
取代或收購競爭對手,獲取新的能力和市場
通過整合或收購獲取原料藥生產
雖然這不是一個詳盡的列表,但顯而易見,這些戰略選擇中的任何一項都需要及時、準確和可靠的綜合信息和工具,以驗證不同的方法並做出正確的決策。比如,為了拓展新的海外市場,不論是CMO還是仿製藥生產商,他們都需要透徹了解相關國家和全球藥政法規,以便於能夠比較和對照不同國家的法規及區別,持續監測這些法規的變化,當進入新市場時,能夠評估相關法規的任何變化對業務產生的影響。
往往我們會發現,那些能夠成功應對上述商業挑戰的公司都有著清晰的增長戰略,采用先進的商業情報和信息係統:
包括高度整合的數據,涵蓋在研產品線、產品、市場、公司、法規和專利信息等關鍵內容。
包括開發專業的分析功能,可節省時間和精力,比如:預估仿製藥上市日期,而不再重複考慮複雜的專利和市場獨占期。
提供與當前和未來業務匹配的區域覆蓋範圍。
針對檢索結果可進行靈活的排序、分析,並具有可視化工具,以便能夠快速測試戰略並對複雜的商業問題提供解答。
這裏舉一個例子,這無疑是今天很多公司會麵臨的情況:新興市場中的一家仿製藥生產商,該公司隻有在本土市場上市固體口服製劑的經驗,現在通過大規模投資實現了工廠升級,希望能進入利潤豐厚的歐美無菌注射劑市場。
強大的、不斷增長的產品組合與在研產品管線是所有生產商成功發展戰略的重要組成部分。至少,公司的信息解決方案必須能夠快速檢索和評估現在的、曆史的和未來銷售預測,上市信息和價格數據,專利信息和市場獨占期信息,預測仿製藥的上市時間,原料藥的供應情況,DMF狀態,訴訟,已生效的交易以及更多其他相關因素。專業信息和工具應該能夠回答具有代表性的產品組合開發和產品選擇等問題,在幾秒中裏生成一張表格,包含可用於進一步詳細評估的候選產品清單:
“哪些產品在美國和歐洲的銷售金額在2億至4億美元之間?年增長率小於5%,上市劑型為小瓶、安瓿瓶或者注射劑,適應症為心血管、中樞神經係統和腫瘤,同時API供應有限,預計2022年至2028年在德國、意大利或者美國有可能仿製藥上市?”
最後一個例子,一旦產品組合確定,那麽需要就藥政法規信息和解決方案提一些問題,以衡量其對預算和計劃的影響:
在所有歐洲國家和美國的市場授權(MA)費用、MA 續期費用、更新時間表、MA 延期費用和年檢費用是多少?
在所有歐洲國家的市場授權(MA) 申請預計審查時間為多少?與美國相比如何?有了這些信息,公司可以更有信心地開發產品,按時間表提交申請,確定每個市場的預算,並且最早地了解如果成功獲批,產品的預期收入是多少。未來幾年,仿製藥行業的前景是光明的,但也會麵臨激烈競爭、更嚴格的監管環境以及其他壓力。但是通過上述多種措施,公司將能夠繼續把重點放在戰略選擇、驗證和規劃上。能夠利用綜合情報和信息的公司將會獲得成功,並繼續實現可持續的增長。














 相關新聞
相關新聞