2016年生物製品批簽發年報出爐,進口疫苗占比持續下降
7月4日,國家食品藥品監督管理總局(簡稱“總局”)發布了2016年生物製品批簽發年報。根據統計,2016 年,簽發疫苗3949 批、約計6.46 億人份;血液製品4025 批,約計5927.80 萬瓶;血篩試劑836 批,約計8.78 億人份。
簽發疫苗51個品種,進口疫苗僅占2.32%
2016年,總局共計簽發疫苗51 個品種、3950 批次,其中3949 批符合規定,隻有長春長生生物科技股份有限公司生產的吸附無細胞百白破聯合疫苗因“無細胞百日咳疫苗效價測定”而被拒簽。
根據報告,從2010 年至2016 年,簽發疫苗品種比較穩定,每年基本維持在50 種左右。不過,疫苗批簽發批次則呈下降趨勢,在2010 -2013 年期間,每年基本是5000 批左右,近三年則維持在4000 批/年左右。
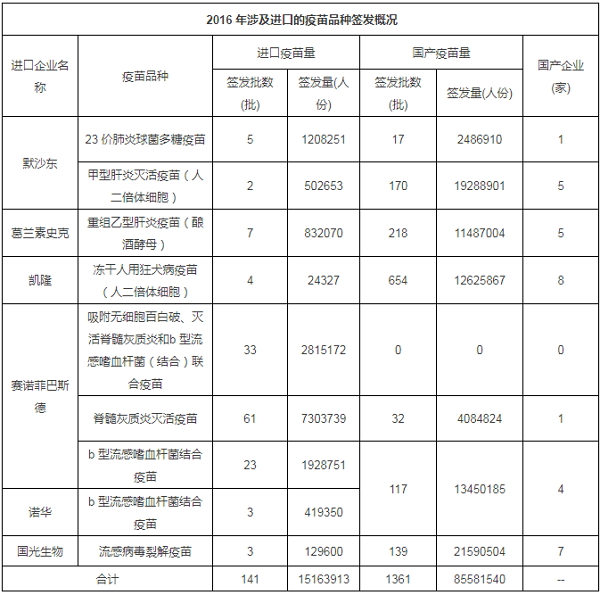
另外值得注意的是,曆年來,在上市的疫苗中,進口疫苗量所占比例比較低。數據顯示,2012年-2014年間,進口疫苗僅在上市疫苗中占得比例不到5%,而2015-2016年間,又呈持續下降趨勢(2015年為2.12%)。2016年,申請疫苗批簽發的國內企業有33 家,簽發的國產疫苗有3808 批、總計6.31 億人份;而進口疫苗隻有141 批、總計0.15 億人份,進口疫苗僅占到了2016年上市疫苗的2.32%。
報告顯示,2016年,有6家進口企業的8中疫苗申報批簽發,其中,除了賽諾菲巴斯德的1種五聯疫苗外,其他7 個品種疫苗均有國產疫苗簽發上市,且大多數國產疫苗批次和簽發量顯著高於進口疫苗。這可能就是進口疫苗量降低的原因之一。
簽發血液製品12 個品種
2016年,全國共簽發血液製品12 個品種,4025 批次,共計5927.8020 萬瓶。其中2批不合格製品為奧地利Baxter AG 生產的人血白蛋白,不合格項目為可見異物。
據統計,2016 年,共有39 家血液製品生產企業申報批簽發,包括27 家國內企業和12 家境外企業。其中,簽發的進口血液製品均為人血白蛋白,共1457 批,總計2048.9743 萬瓶,占到了人血白蛋白總數的56.25%。
在血液製品中值得一提的是用於血友病患者治療的人凝血因子Ⅷ,該產品在國內市場屬於供應短缺產品。數據顯示,近年來,進口人凝血因子Ⅷ的數量呈逐年增加的趨勢,2016 年進口人凝血因子Ⅷ達68.59 萬瓶,占比達到了41%,進口人凝血因子Ⅷ市場主要被拜耳、百特和惠氏三家公司霸占。目前國內有5 家企業生產人凝血因子Ⅷ,2016 年簽發國產製品98.86 萬瓶。
簽發血源篩查用體外診斷試劑9個品種
2016 年中檢院共簽發血源篩查用體外診斷試劑836 批。約計8.78 億人份,涉及9個品種,24 家生產企業。其中,進口製品64 批(占總簽發批數的8%)約計0.3 億人份(占總簽發人份數的3.5%),涉及6 個品種,5 家進口生產企業。
關於批簽發管理製度
中國自2001 年對6 種生物製品(麻疹減毒活疫苗、吸附白百破疫苗、脊髓灰質炎減毒活疫苗、乙型肝炎疫苗、皮內注射用卡介苗和人血白蛋白)試行批簽發。2006 年對疫苗和血液製品全麵實施批簽發製度。目前,中國納入批簽發管理的生物製品包括全部疫苗類製品、國產血液製品和進口人血白蛋白、血源篩查用體外診斷試劑(簡稱“血篩試劑”)。2016年,經總局研判,決定對乙肝/丙肝/艾滋核酸檢測血篩試劑也實施批簽發管理。

分享到:














 相關新聞
相關新聞