為鼓勵研究創製新藥,提升我國自主創新能力,加強藥品注冊管理,加快具有臨床價值的新藥和臨床急需仿製藥的研發上市,國家開啟了“特殊審批”、“重大專項”、“優先審評”等藥品的特殊審批通道。
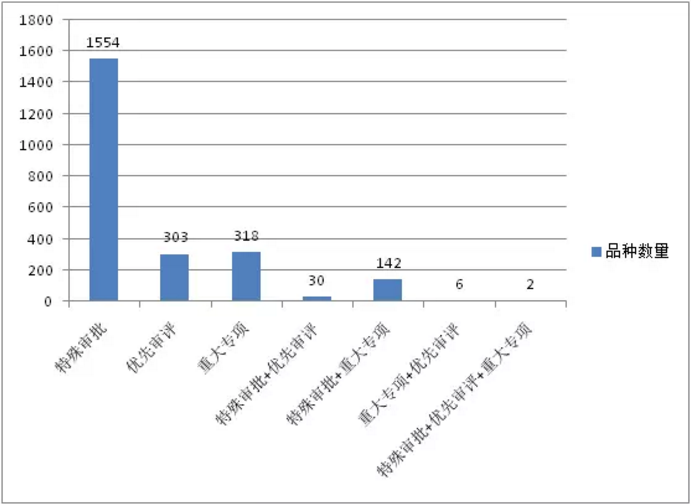
根據藥智數據統計,國家藥品審評中心(CDE)曆年受理的“特殊審批”、“重大專項”、“優先審評”品種數量走勢如圖1、2所示。“特殊審批”相關受理號從2004年開始出現,截止2017年6月30日,累計受理1554個特殊審批品種(按受理號計,下同);2005年開始出現“重大專項”相關受理號,截止6月30日累計受理318個重大專項品種;“優先審評”相關受理號從2010年開始出現,截止6月30日累計受理303個優先審評品種。從受理品種數量來看,特殊審批品種遠超優先審評、重大專項品種,是其受理數量總和的2.5倍之多。
圖1:“特殊審批”、“重大專項”、“優先審評”品種數量及組合數量
注:“特殊審批+優先審評”:既是特殊審批又是優先審評的品種;“特殊審批+重大專項”:既是特殊審批又是重大專項的品種;“重大專項+優先審評”:既是重大專項又是優先審評的品種;“特殊審批+優先審評+重大專項”:既是特殊審批又是優先審評還是重大專項的品種。
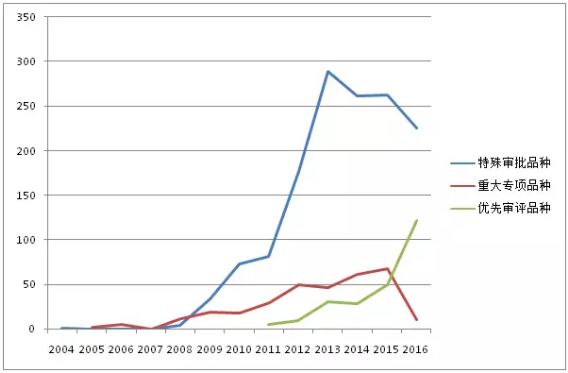
圖2:CDE曆年受理的“特殊審批”、“重大專項”、“優先審評”品種走勢
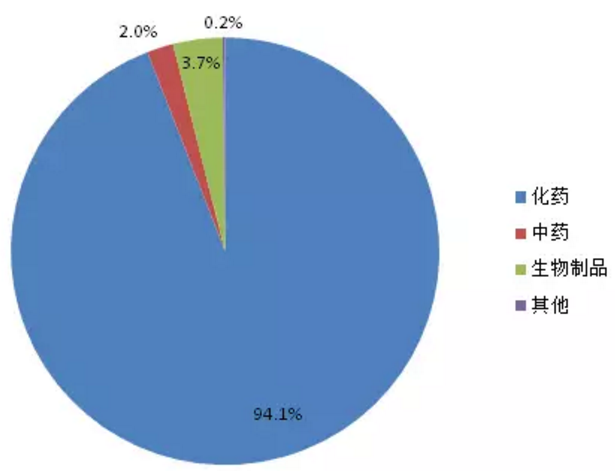
特殊審批品種自2004年出現第1個受理號後,2005-2007年期間沒有品種被受理,直到2008年。2008-2013年之前受理數量一直處於快速增長階段,2013年達到峰值289個,2013年之後三年期間受理數量開始下滑。2017年上半年受理146個品種。1554個特殊審批品種大多為化藥(如圖3所示),占比高達94.1%,其他類型藥品僅占5.9%。
重大專項品種受理數量在2015年之前一直呈現出波浪式上升趨勢,2015年達到峰值67個。但2016年僅10個品種被受理,2017上半年也未有品種被受理。318個重大專項品種各藥品類型占比如圖4所示,中藥占到6.6%。
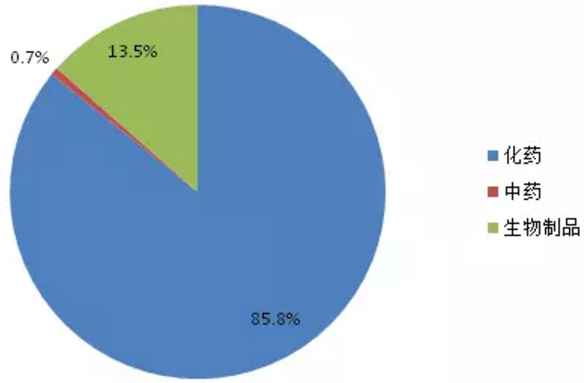
優先審評品種開始受理的5年期間,受理數量一直呈現上升趨勢,2016年更有122個品種被受理。2017上半年也有58個品種被受理。303個優先審評品種按藥品類型分類,化藥仍占主導地位(如圖5所示),占比達85.8%,生物製品占13.5%。
圖3:特殊審批品種藥品類型占比
圖4:重大專項品種藥品類型占比
圖5:優先審評品種藥品類型占比
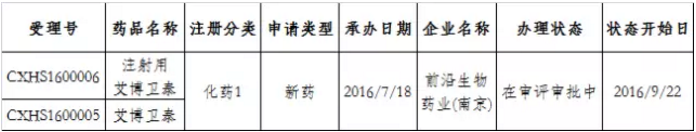
截至目前,前沿生物藥業(南京)股份有限公司的化學1類新藥“艾博衛泰”及製劑“注射用艾博衛泰”是CDE唯一受理的既是“特殊審批”又是“優先審評”還是“重大專項”品種。2016年7月被受理,目前還在審評審批中(如表1所示),係複方類治療HIV感染的抗病毒藥物,也是全球第一個長效HIV融合抑製劑。
表1:既是“特殊審批”又是“重大專項”還是“優先審評”的品種
2017上半年CDE受理的特殊審批品種分析
截止6月30日,2017上半年CDE受理特殊審批品種146個,按不同分類方式細分如下:
藥品類型:化藥145個,生物製品1個,無中藥等其他類型;
申請類型:新藥120個,進口26個,無仿製藥等其他類型;
注冊分類:化藥1類140個,化藥2.4類3個,化藥1.1類2個,預防用生物製品1類1個;
辦理狀態:在審評的有132個,製證完畢-已發批件的有14個。
特殊審批品種數量≥4的企業及分屬品種數如圖6所示,排名居前的企業大多為國內製藥企業,江蘇恒瑞遠居榜首,有13個品種被受理,跨國企業僅葛蘭素史克(中國)一家。
圖6:特殊審批品種數量≥4的企業及分屬品種數
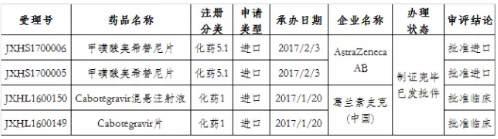
值得一提的是,在這146個品種中,有8個既是特殊審批又是優先審評品種,其中Cabotegravir混懸注射液和Cabotegravir片已獲批臨床,兩個品種申請類型均係進口(如表2所示)。
表2:8個既是特殊審批又是優先審評的品種

2017上半年CDE受理的優先審評品種分析
截止6月30日,2017上半年CDE受理優先審評品種58個,按不同分類方式細分如下:
藥品類型:化藥46個,生物製品12個,無中藥等其他類型;
申請類型:新藥11個,仿製藥15個,進口29個,補充申請3個;
注冊分類:化藥1類8個,化藥3類4個,化藥5.1類17個,化藥6類10個,治療用生物製品6個,治療用生物製品15類1個,治療用生物製品9類1個,預防用生物製品1類1個,預防用生物製品9類1個;
任務類型:NDA申請14個,ANDA申請15個,IND申請3個,上市申請7個,臨床試驗申請2個,補充申請(臨床)2個,驗證性臨床3個;
辦理狀態:在審評的有53個,製證完畢-已發批件的有4個(2個批準臨床,2個批準進口,如表3所示)。
表3:4個製證完畢-已發批件的優先審評品種
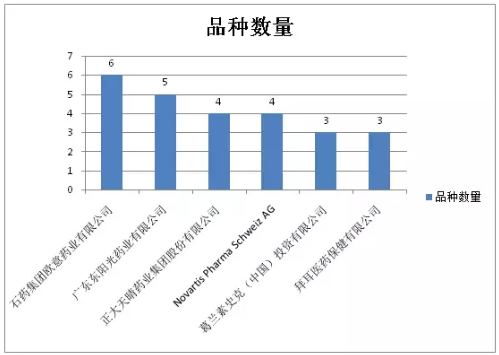
去除補充申請後,優先審評品種數量≥3的企業及分屬品種數如圖7所示,國內、跨國企業各占半壁江山。冠軍和亞軍分別為石藥集團歐意藥業和廣東東陽光藥業。
圖7:優先審評品種數量≥3的企業及分屬品種數

















 相關新聞
相關新聞