創新是一個民族進步的靈魂,是一個國家興旺發達的不竭動力。在化學藥物領域,我國《藥品注冊管理辦法》界定的1類新藥則代表了國家創新藥物的研製水平,是挑戰最大的化藥創新。麵對著1類新藥漫長的研發與申報周期,巨大的研發成本與不可預知的研發風險,能讓製藥企業一擲千金地專注於1類新藥研發的最大動力,莫過於藥品上市後帶來的巨大商業回報。
9月8日-10日,藥智網攜手中國藥房雜誌社聯合主辦的《2017中國醫藥創新高峰論壇•暨醫藥企業研發實力百強榜單發布》在重慶耀世啟幕,會議將隆重發布《2017年藥品研發實力排行榜》(包括其子榜《2017中國化藥研發實力排行榜》),哪些是醫藥行業的領軍企業?哪些將憑借夯實的化藥研發實力入圍“化藥榜”?歡迎大家蒞臨會場觀摩。
本文參考 “藥智藥品注冊與受理數據庫”、相關的新聞報道,搜集了近20年內獲得CFDA批準的國產1類化學藥品信息,對其市場表現進行了分類點評,借以了解1類新藥上市後對製藥企業帶來的商業回報。
一、不負所望篇
1、埃克替尼
埃克替尼是由浙江貝達藥業有限公司研發,並於2011年6月初獲CFDA批準的我國首個具有自主知識產權的小分子靶向抗癌藥(藥用其鹽酸鹽片劑,商品名:凱美納),被前衛生部部長陳竺評價為“民生領域堪比兩彈一星的重大突破”。埃克替尼的第一個適應證是晚期非小細胞肺癌(NSCLC)。凱美納的第一個適應症是晚期非小細胞肺癌(NSCLC),肺癌是全世界範圍內各種惡性腫瘤中的第一殺手,也是自2005年以來中國位居第一的死亡病因,而NSCLC約占所有肺癌患者的85%。一項頭對頭Ⅲ期臨床試驗結果證實,埃克替尼對NSCLC的治療效果與吉非替尼,但其價格卻遠低於國內占主導地位的NSCLC治療藥物-吉非替尼與厄洛替尼。
根據藥智網提供的2017年7月26日重慶市藥品招標信息,0.125g規格埃克替尼片單價為61.62元/片,而同期中標的厄洛替尼片(進口)與吉非替尼片(國產)單價分別為474.28元/片與158.5元,而進口吉非替尼片於2017年7月初在江西的中標價為235.8元/片。
2014年,埃克替尼治療EGFR突破的適應證獲批準,2017年埃克替尼與實現國產化的吉非替尼、達沙替尼、伊馬替尼進入國家醫保目錄。
市場獨占情況
貝達藥業針對埃克替尼進行了全麵的專利布局,以其化合物專利(專利號:03108814.7,下文簡稱814’號專利)為核心,但該專利卻屢遭國內自然人或企業的專利挑戰。
2014年9月,付某針對814’號專利向專利複審委員會提出無效宣告請求,認為該專利的權利要求1-14的技術方案在說明書中未公開,不符合專利法第二十六條第三款的規定。隨後在2014年11月,自然人王某也向專利複審委員會提出無效宣告請求,認為該專利的權利要求1-14的修改不符合專利法第三十三條的規定;權利要求1-14的技術方案不符合專利法第二十六條第三款的規定;權利要求1-7、10-14得不到說明書的支持,不符合專利法第二十六條第四款的規定;權利要求1-14不符合專利法第二十二條第三款的規定。其實早在2011年9月,就曾有公司針對該專利提出過專利權無效宣告請求,但在口頭審理結束後雙方便達成和解,該公司撤銷了無效宣告請求。
2015年10月9日,專利複審委員會做出第27258號決定,表示維持814’號專利繼續有效。
目前,埃克替尼及其片劑國內僅有貝達藥業一家生產。
市場表現
《知識產權報》於2016年7月報道上述專利無效案時援引數據稱,埃克替尼先後於2013年、2014年、2015年為貝達藥業帶來了4.75億元、7.03億元與9.13億元的收入。另有多個專業媒體均報道稱,埃克替尼2016年銷售額已超過10億元。
2、丁苯酞
丁苯酞是由中國醫學科學院藥物研究所和石家莊製藥集團有限公司等單位共同研發的我國第一個擁有自主知識產權的腦血管疾病治療藥物,於2004年11月正式投產,藥用其氯化鈉注射液與軟膠囊,商品名“恩必普”。丁苯酞研發項目先後被列入國家自然科學基金、“八五”和“九五”國家科技攻關項目。“十五”期間,該項目又被科技部列入國家高技術研究發展計劃(863計劃)、“創新藥物和中藥現代化”重大科技專項,其原料藥與軟膠囊項目獲得2009年國家科技進步二等獎。本品於2009年進入國家醫保目錄。
市場獨占情況
雖然丁苯酞是存在於南方泥水匠菜籽中的一種極微量天然單體,而其研發也經曆了二十年的漫長曆程,但石藥集團及其相關企業通過製劑及其製備方法專利,很好地實現並延長了市場獨占,其中而“丁苯酞軟膠囊及其製備”專利(專利號:200310119336.1)於2012年獲得第十三屆專利金獎。
目前僅有石藥集團恩必普藥業有限公司持有丁苯酞及其氯化鈉注射與軟膠囊劑的生產批文。
市場表現
目前,暫時未發現披露丁苯酞整體銷售額的數據。根據Pharmarket數據庫信息,2016年全國22個重點城市樣本醫院內丁苯酞的用藥金額達6.87億元,相信其全國整體銷售額已經遠超10億元。
丁苯酞的商業成功經曆了相對曲折的過程。國內某專業媒體2014年11月發表的《恩必普》一文指出,丁苯酞於2004年取得新藥證書並上市以後,由於難進醫院主渠道,產品連年虧損,不但新藥研發初期國家各部委對丁苯酞投入項目資金難有回報,企業的巨額投入也難以收回,同時還麵臨著專利期不斷荒廢的窘境。根據國內22個城市樣本醫院數據,2005-2009年,丁苯酞市場一趟處於低迷狀態,樣本醫院內用藥金額基本維持在200萬-600萬元之間,五年來未突破千萬元大關。2010年起,呈場開始呈迅速上升態勢,用藥金額從2005年的159萬元,增長至2013年的3.3億元。此8年市場增長210倍,年度複合增長率高達95.0%。
《石家莊日報》2007年12月5日發表的一篇名為《丁苯酞為何“牆內開花牆外香”》一文將丁苯酞上市後早期國內市場的低迷歸因於化合物專利的缺失。
3、雙環醇
雙環醇片,商品名為百賽諾,是我國第一個具有自主知識產權的抗肝炎新藥,由中國醫學科學院藥物所藥理學家、中國工程院院士劉耕陶教授及著名藥物化學家張純貞教授合作的科研小組曆經15年艱辛研製成功,於2001年9月獲新藥證書與藥品注冊文號,持有人為北京協和藥廠。此前的2001年2月“抗肝炎新藥雙環醇的研究”項目獲得由科學技術部、財政部、國家發展計劃委員會及國家經濟貿易委員會聯合頒發的“九五”國家重點科技攻關計劃優秀科技成果獎,並入選2001年度中國十大醫藥科技新聞。上市後,雙環醇先後榮獲2005年北京科技一等獎與國家科技進步獎。
市場獨占情況
1988年起,雙環醇獲得美、歐、日、韓等15個國家與台灣地區的物質發明專利,但由於當時我國的專利法不對藥品授予專利權,故未能獲得國內專利。中國醫學科學院藥物研究所針對雙環醇申請了一係列外圍專利,其中包括“光活雙環醇及其製備方法和其藥物組合物與用途”(專利號:02156723.9,尚在有效期內),對市場獨占權起了一定的保護作用。2009年該專利的專利權人變更為北京協和藥廠,目前也隻有北京協和藥廠一家國內企業持有雙環醇及其片劑的生產批文。
市場表現
《河北日報》2014年2月20日發表的一篇名為《十年“冷板凳”隻為創新藥》一文援引數據稱,雙環醇上市後當年銷售額為8000萬元,第三年便超過了1億元。《科技日報》2016年10月28日發表的《十大科技成就》一文稱,獨家產品雙環醇銷售額達30億元(推測是累積銷售額),份額穩居國內口服保肝用藥的首位,已在俄羅斯等“一帶一路”沿線7國注冊上市。
4、異甘草酸鎂
異甘草酸鎂注射液(商品名“天晴甘美”)是由正大天晴藥業利用天然藥物甘草有效成分研製的抗肝炎創新藥,於2005年9月獲得CFDA頒發的新藥證書與生產批件。異甘草酸鎂是一種全新結構的手性化合物,是甘草酸的單一旋光異構體,具有很強的抗炎、保護肝細胞膜、抗生物氧化等多種藥理作用,在藥理學及藥代動力學等多方麵具有突出的優勢。臨床試驗顯著其起效迅速,降酶速度和降酶程度均明顯高於其他產品,應用範圍廣,適用於各種肝病的治療,改善肝功能。異甘草酸鎂注射液是國家乙類醫保用藥。
市場獨占情況
正大天晴申請並獲得授權的異甘草酸鎂化合物專利(專利名稱:一種新的化合物異甘草酸鎂及其生產方法和用途,專利號:02111693.8)於2007年獲得國家專利金獎。目前僅有正大天晴一家企業持有異甘草酸鎂及其注射液的生產批文。
市場表現
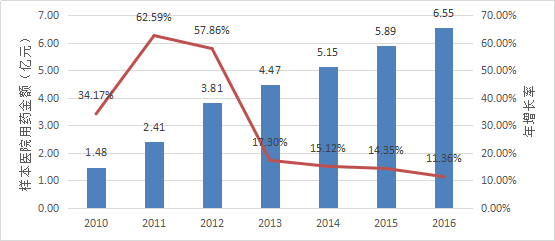
國內3家媒體報紙於2012年發表文章報道稱,2011年異甘草酸鎂注射液的銷售額達8億元。
根據Pharmarket數據庫信息,2010年以來異甘草酸鎂在全國22個重點城市樣本醫院內用藥金額的變化情況如下表所示。
5、艾普拉唑
艾普拉唑是1998年韓國一洋藥品株式會社研發的新藥,2001年麗珠醫藥集團與一洋簽訂關於該品種的《專利許可協議》,取得該產品在中國內地、香港、澳門等地區的獨家生產、加工和銷售權。雖然是專利許可的品種,但麗珠集團在該品種的投資並不亞於自主研發的品種,集團承諾投資1.156億元用於建設艾普拉唑原料及製劑的產業化項目。
艾普拉唑於2007年12月獲CFDA批準用於治療胃潰瘍等疾病,藥用其5mg腸溶片,商品名“壹麗安”。與以往的胃藥相比,艾普拉唑具有明顯的優勢。一是抑製胃酸的活性更強,同等劑量藥效高4倍;二是對不同代謝型患者無個體差異;三是毒副反應更少。2017年,艾普拉唑進入國家醫保目錄。
市場獨占情況
如前所述,韓國一洋藥品株式會社將艾普拉唑在中國內地等地區的化合物專利權許可給了麗珠集團。
目前僅有麗珠集團一家企業持有艾普拉唑及其腸溶片的生產批文。
市場表現
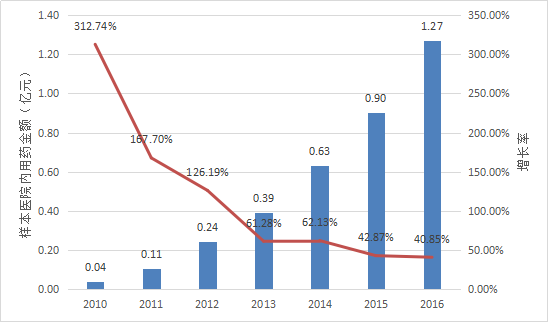
暫無數據披露了艾普拉唑的整體銷售額信息。
根據Pharmarket數據庫信息,2010年以來艾普拉唑在全國22個重點城市樣本醫院內用藥金額的變化情況如下表所示。
二.前景可期篇
1、阿帕替尼
阿帕替尼是由江蘇恒瑞醫藥股份有限公司研發的全球第一個在晚期胃癌患者中被證實安全有效的小分子抗血管生成靶向藥物,也是晚期胃癌標準化治療失敗後,單獨用藥療效最好的藥物,同時阿帕替尼是胃癌靶向藥物中唯一的一種口服製劑,從而極大了提高了患者的依從性。2014年6月,埃克替尼的臨床研究被美國臨床腫瘤學會(ACOS)選作大會報告,這是中國創新藥研究第一次在全球頂級學術會議上作大會報告,第一次入選該年會優秀研究。根據2015年中國癌症報告,2015年我國預計67.9萬例胃癌病例,預期死亡49.8萬人。
阿帕替尼片於2014年10月獲CFDA批準,藥用其甲磺酸鹽片劑,商品名艾坦,共有0.25g、0.375g與0.425g三種規格。根據藥智網提供的2017年重慶與江西最新的藥品招標信息,本品0.25g、0.375g與0.425g規格的單價分別為 215.1元、296.1元與324.64元。
市場獨占情況
恒瑞醫藥申請的第200810149651.1號中國專利保護了阿帕替尼及其甲磺酸鹽,該專利已獲授權,將於2028年失效。目前僅有恒瑞醫藥一家企業持有阿帕替尼及其片劑的生產批文。
市場表現
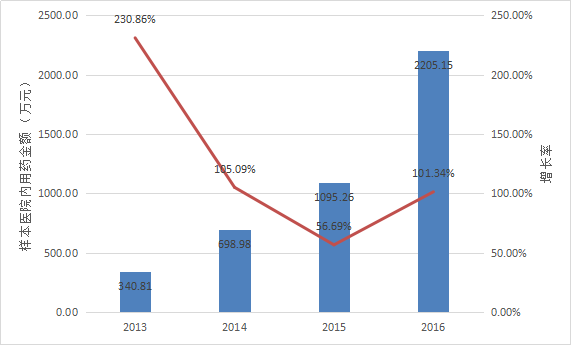
目前暫無數據直接披露阿帕替尼的整體銷售額。
根據Pharmarket數據庫信息,2015年與2016年,全國22個重點城市樣本醫院內阿帕替尼的用藥金額分別為5946.85與7860.19萬元,2016年較2015年同比增長32.17%。
2、艾拉莫德
艾拉莫德是由天津藥物研究院與江蘇先聲藥業有限公司投資數億元,曆時12年而研發成功的我國擁有自主知識產權的全球首個小分子治療類風濕性關節炎藥物,於2011年8月獲1類新藥證書及藥品注冊批文,藥用其25mg片劑,商品名“艾得辛”,而其上市後研究被納入科技部“十二五”重大創新科技重大專項支持項目。
中華醫學會風濕病學分會主任委員會、北京大學人民醫院風濕免疫科主任栗占國於2012年1月接受《健康報》記者采訪時表示,類風濕性關節炎是全球致殘率最高的疾病之一,在我國約有500萬名患者需要治療。“艾得辛”上市之前,臨床使用的藥物多為症狀治療,且存在濫用激素、止痛藥等不規範治療的行為,治療效果也不理想。艾得辛治療風濕性、類風濕性關節炎,最快4周~6周即可起效,可抑製多種細胞因子和類風濕因子的表達,明顯改善類風濕性關節炎患者的症狀與體征。此外,艾得辛還能有效阻止骨質破壞,降低患者的致殘致畸率。艾拉莫德於2014年被寫入亞太抗風濕病聯盟的類風濕治療指南,並於2017年被納入國家醫保。
市場獨占情況
目前,僅有先聲藥業一家企業持有艾拉莫得及其片劑的生產批文。
市場表現
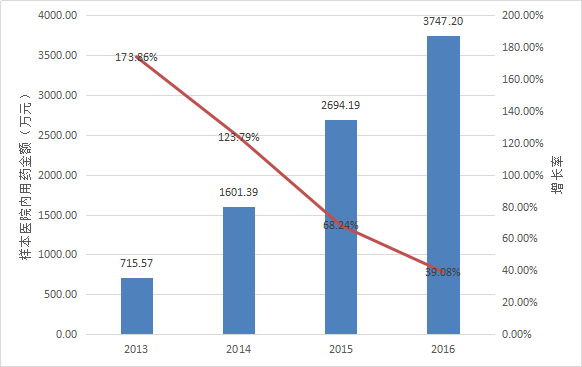
暫無數據披露了艾普拉唑的整體銷售額信息。
根據Pharmarket數據庫信息,近年來艾拉莫德在全國22個重點城市樣本醫院內用藥金額的變化情況如下表所示。
3、艾瑞昔布
艾瑞昔布是江蘇恒瑞醫藥自主研發的1類新藥,於2011年5月獲批,商品名為“恒揚”,藥用其0.1g片劑。艾瑞昔布緩解骨關節炎患者疾病症狀的效果及胃腸道安全性特征均與塞來昔布相當,但其心血管、腎髒安全性特征更優。2017年,艾瑞昔布被納入國家醫保。
市場獨占情況
目前,僅有恒瑞醫藥一家企業持有艾瑞昔布及其片劑的生產批文。
市場表現
暫無數據披露了艾普拉唑的整體銷售額信息。
根據Pharmarket數據庫信息,近年來艾拉莫德在全國22個重點城市樣本醫院內用藥金額的變化情況如下表所示。
三.小結
提到創新藥物的研發,大多會用“十年磨一劍”來形容其過程的漫長,然而“劍”磨好後,是“立即露鋒芒”還是“鋒芒久未露”卻受著太多因素的影響。與國外情況一樣,除了少數特效藥或急需藥,大多數創新藥從上市到實現“豐厚的商業回報”會經曆或長或短的過程。
2000年以後批準上市的國產1類化藥新藥屈指可數,其上市後市場的表現也各不相同。丁苯酞、雙環醇、異甘草酸鎂與艾普拉唑均是21世紀第1個10年內批準的新藥,在經曆了漫長的市場積累後,均已在樣本醫院內實現了過億的年度銷售額。埃克替尼在上市5年後即已實現了10億元的銷售業績,的確是國內創新藥物前所未有的商業奇跡。而阿帕替尼、艾拉莫德與艾瑞昔布上市較晚,其樣本醫院內用藥金額尚處於千萬元級別,但每年均保持著2位以上的增長率,過億指日可待。
除了本文所述的幾種新藥,CFDA還於2016年10月批準了泰州複旦張江藥業的海姆泊芬及其注射劑用於治療皮膚病,於2014年2月批準江蘇豪森的嗎啉硝唑及其氯化鈉注射液用於治療細菌性感染、2013年4月批準廣州南藥新藥的帕拉米韋及其氯化鈉注射液用於治療流感,但上述三種1類化藥的市場規模均尚未明朗,故未予以論述。
當然,由於筆者資源與精力的限製,對1類新藥品種的搜集以及各品種信息的整理難免有遺漏,還望廣大讀者朋友不吝指正、補充。
最後,既然本文所述為化藥1類新藥,不得不說的一個品種就是青蒿素。之所以沒有在前文對其進行論述,是因為青蒿素的價值已經大大超出了商業指標所能衡量的範圍,它是新中國老一代科學家為世界人民健康事業所做的巨大貢獻,也是留給中國新藥研發的一筆巨大的精神財富!














 相關新聞
相關新聞