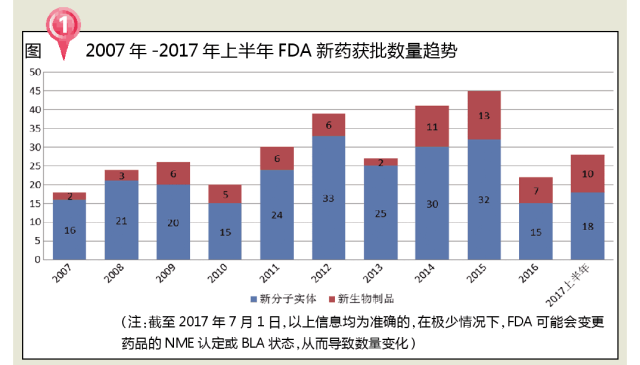
2017年上半年,FDA共批準新藥28個,比2016年一整年獲批新藥還多出6個!
分析近十年FDA批準新藥數量發現,2007~2015年,FDA每年批準新藥數量整體上呈現上升趨勢,但2016年批準數目有所回落。究其原因發現:一是有5種NME計劃2016年批準,被提前到2015年;二是2016年申請的數目較少,而發布的完整回應函(Complete Response,CR)較多;三是有相當部分申請還在審理之中,不能被歸為獲批一類。
所謂CR函,類似於國內的補充通知,是FDA以書麵的形式向申請者發送的函件,其中完整描述了FDA發現的提交申請資料中所有缺陷和不足之處,指導申請人補充資料以便能夠獲得批準。
2017年是GDUFA法案實施的關鍵年,FDA將藥物審評與之相結合,在創新/突破性藥物加速審批中取得了顯著成效,有效地加速了創新藥及罕見病治療藥物的審批和上市進程。同時,和以往相比,FDA在限製獲批藥物的使用上有更強的掌控力,因此創新藥物和生物製藥的審評審批取得了突破性進展。除了政策方麵因素外,藥品審批加速更有賴於製藥企業在研發前期與官方密切溝通,例如百時美施貴寶研發的Opdivo在4天內獲批,得益於其臨床研究期間主動與FDA審評專家建立密切的溝通,促使審評專家能及時獲知企業研發動態和詳情,這對於推動Opdivo在後期快速獲批有很大幫助。
18個新分子實體
7個孤兒藥,11張優先審評券
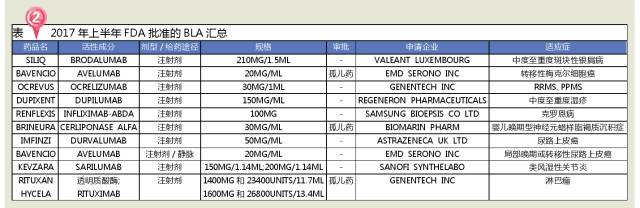
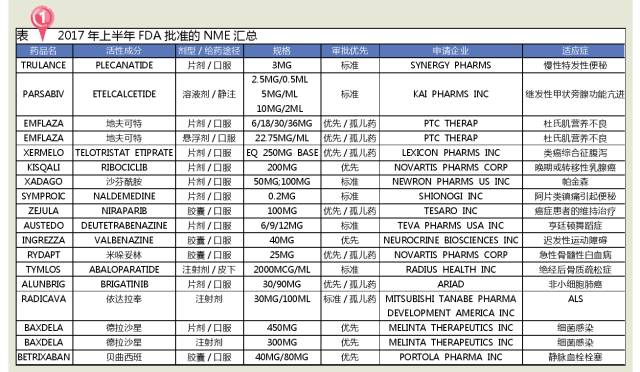
2017年上半年(截至7月1日),FDA共批準了18個新分子實體(11個優先審批和7個標準審批),其中有7個孤兒藥,占全部審批數量的38.9%,主要集中在腫瘤、DMD等治療領域。從2007年設立優先審評製度以來,至2016年底,FDA共發放12張優先審評券,其中有3張是2016發布;2017年上半年,已收到11張優先審評券,接近過去9年收到的總和!FDA逐步放開審評,孤兒藥等有重大治療優勢的藥品將迎來新的春天。
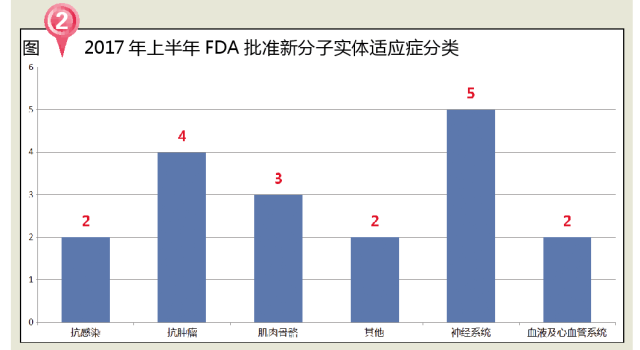
從治療領域來看,2017年上半年FDA批準的NME主要包括5個神經係統用藥、4個抗腫瘤藥、3個肌肉骨骼用藥,抗感染、心血管係統和其他用藥各2個。
神經係統藥物市場是全球占比極大的一類用藥領域。我國的神經係統用藥市場在醫藥終端臨床使用的比重也在逐漸提高。2015年我國神經係統藥物市場規模為1047.84億元,根據Lancet和LancetPsychiatry的三篇論文顯示,我國精神疾病患者占全球的17%左右,但是受資源匱乏和偏見影響,絕大多數患者尚未得到有效治療。2017年上半年FDA批準的18個新分子實體中,神經係統用藥占比28%。在市場競爭越來越激烈的情況下,神經係統用藥的市場是一個非常好的利潤爭奪點,從企業層麵考慮,如何占領這樣一個巨大的市場也是麵臨的一個問題。
10個生物製品
9個創新藥,1個生物類似藥
2017年上半年,FDA共批準了10個生物製劑,其中創新藥9個,僅SAMSUNG BIOEPSIS公司研發的RENFLEXIS為生物類似藥。
IMS Health統計表明,2014年全球生物藥市場規模已達到 2140億美元,市場占有份額也從2001年的10.5%增長至2014年的21.3%,以高於全球製藥市場增長的良好態勢蓬勃發展。
近幾年來,技術方麵的突破也會加速生物技術在製藥領域的應用和新藥的研發。在這樣的背景下,全球製藥巨頭都瞄準了生物製藥這一新興領域,爭相開發生物醫藥市場。
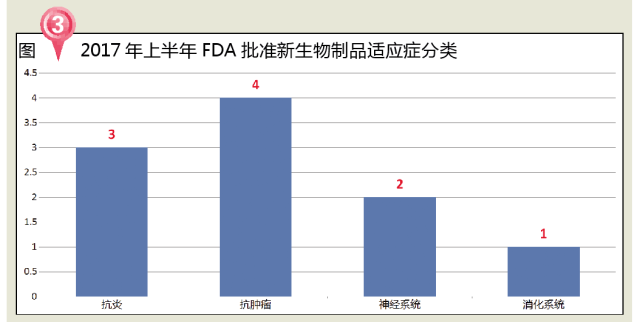
從治療領域來看,2017年上半年FDA批準的BLA主要包括4個抗腫瘤藥、2個抗炎藥、2個神經係統用藥和1個消化係統用藥。
腫瘤治療無疑是創新藥最具前景的領域。根據分析機構數據,2015年全球抗癌藥物市場容量超過1000億美元,複合增長率為6.5%左右,2020年有望增至1500億美元。從1997年FDA批準第一個靶向腫瘤藥物Rituxan(利妥昔單抗)起,FDA開啟了腫瘤治療藥物的審批新時代,近幾年FDA更是將創新藥品的審批重點放在抗腫瘤藥物領域。
6個潛在“重磅炸彈”
3個品種預測銷售額20億美元以上
根據EvaluatePharma對2022年藥品銷售的預測數據,2017年上半年FDA批準的多個藥品將有希望成為重磅新藥,其中治療皮炎的Dupixent、治療多發性硬化症的Ocrevus和治療膀胱癌的Durvalumab等生物製劑有望突破20億銷售額大關。
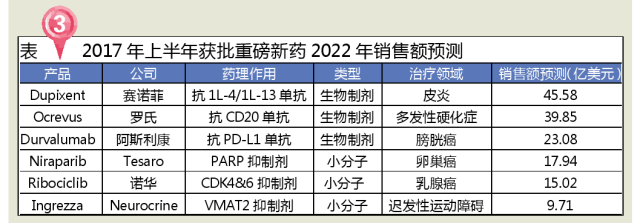
Dupixent是賽諾菲與美國Regeneron生物醫藥公司研發的用於成年患者治療中度至重度濕疹的注射劑,是首個也是唯一一個獲批治療中重度特異性皮炎(AtopicDermatitis,AD)的生物製劑。特應性皮炎(AD)是一種慢性、複發性、炎症性皮膚病,與遺傳、免疫及環境等多種因素有關,多於嬰幼兒時期發病,隨著年齡的增長,其出現過敏性鼻炎、哮喘的幾率明顯增加。在美國,中度至重度不受控的特應性皮炎成年人中,約30多萬人次需要創新治療方案來改善病情。Dupixent可同時阻斷細胞因子IL-13和IL-4的信號通路,該信號通路過度激活是造成特應性皮炎(濕疹)、哮喘等疾病的主要原因,根據預測,Dupixent有望成為一款改變皮炎相關疾病治療規則的藥物。
Ocrevus是基因泰克(2009年被羅氏收購)研發的用於複發型多發性硬化症(RRMS)和原發進展型多發性硬化症(PPMS)的注射劑,是FDA批準的首款PPMS藥物,是一種B細胞CD20抗原抑製劑單克隆抗體。醫療市場調研公司EvaluatePharma預測,Ocrevus到2020年的年銷售額將達到27億美元。多發性硬化症(multiplesclerosis,MS)是一種慢性、炎症性、脫髓鞘的中樞神經係統疾病,可引起各種症狀,包括感覺改變、視覺障礙、肌肉無力、精神憂鬱等,現有治療方案隻能阻止該疾病的複發,但無法逆轉其病理狀況。主要分為複發緩解性MS(RRMS)、繼發進展型MS (SPMS)、原發進展型MS (PPMS)、複發進展型MS (PRMS)四類,多數患者為RRMS。
Imfinzi(Durvalumab)為阿斯利康開發的PD-L1抗體,2017年5月3日獲FDA加速批準用於治療局部晚期或轉移性尿路上皮癌患者,適用於以含鉑類藥物化療或化療後疾病進展的患者,或術前術後以含鉑類藥物化療的12個月內疾病進展的患者。Durvalumab的上市,意味著目前市場上一共有5種PD-1/PD-L1抗體藥物,除了Durvalumab,還包括:默沙東的Keytruda、BMS的Opdivo、羅氏的Tecentriq和輝瑞默克的Bavencio。Durvalumab最常見的不良反應(≥15%的患者)是疲勞、肌肉骨骼疼痛、便秘、食欲減退、惡心、外周性水腫和尿路感染。
Zejula(Niraparib)是美國Tesaro研發的用於接收鉑類藥物治療後完全應答或部分應答但又疾病複發的成人卵巢上皮癌、輸卵管癌和原發性腹膜癌患者的維持治療的聚ADP核糖聚合酶(PARP)抑製劑。Zejula是FDA批準的第三個PARP抑製劑(其它兩個為2014年AstraZeneca的Lynparza,以及2016年Clovis的Rubraca),也是第一個用於維持療法的PARP抑製劑。在全球,有近170萬病例。1%~5%的乳腺癌病例是由於BRCA1或BRCA2基因的遺傳突變造成的。一則在NatureMedicine上發表的文章揭示了高達20%的婦女接受PARP抑製劑治療的可能性,PARP抑製劑是一種以前僅被認為對具有遺傳性BRCA1或BRCA2突變的婦女有效的藥物。
Kisqali(Ribociclib)是諾華研發的用於絕經後激素受體陽性、人類表皮生長因子受體-2陰性(HR+/HER2-)的晚期或轉移性乳腺癌女性患者的製劑,是FDA批準的第二款CDK4/6抑製劑(2015年2月輝瑞的Ibrance)。乳腺癌是美國婦女第二常見的癌症。據美國癌症學會估計,2017年約有25萬多婦女將被診斷為浸潤性乳腺癌,而且高達三分之一的早期乳腺癌患者將隨後發展成轉移性疾病階段。Kisqali的Ⅲ期臨床研究MONALEESA-2的數據顯示,與來曲唑(一種芳香酶抑製劑)單藥治療相比,Kisqali聯合來曲唑使疾病進展或死亡風險顯著降低了44%。
Ingrezza(valbenazine或NBI-98854)是一種新型選擇性囊泡單胺轉運體2(VMAT2)抑製劑,也是FDA批準的首個用於治療成人遲發性運動障礙(TD)藥物,與VMAT1、DA受體、5-HT受體的親和力較低,可降低發生相關副作用的理論風險,還可與抗精神病藥或抗抑鬱藥聯用。曾獲得美國FDA頒發的突破性療法認定和優先審批權。遲發性運動障礙是一種中樞神經係統疾病,表現為軀幹、四肢、麵部等出現不自主的重複異常運動。這往往是由於其他藥物所導致,如在精神分裂症、雙相人格障礙與抑鬱症的治療中,抗精神病藥會抑製大腦內的多巴胺受體,而這會導致一些人體內的多巴胺信號通路出現紊亂。如果這些紊亂發生在腦部控製運動的區域,就會造成遲發性運動障礙的症狀。值得一提的是,INGREZZA和梯瓦的Austedo(氘代丁苯那嗪)結構非常類似,但Ingrezza並沒有Austedo的抑鬱和自殺念頭的黑框警告。INGREZZA的搶先上市對Austedo顯然是個不利的消息。
小結
2017年是值得期待的一年,隨著特朗普成為美國總統,美國醫藥工業將迎來重要變革。美國“公共健康守門人”FDA掌門人也完成更迭,2017年5月11日,頗具爭議的FDA新任掌門人Scott Gottlieb走馬上任,醫療和藥品監管政策將會有重要變革,最近FDA以非法濫用為由對阿片類止痛藥opanaER主動撤市以及推出的仿製藥優先審評是一個非常明顯的信號。在FDA法規監管可能出現震蕩的形勢下,各個製藥企業該如何把握,將又是一個世紀看點。


















 相關新聞
相關新聞