背景
從2015年開始,國內醫藥政策發生了顛覆性的改革,這股風暴一直刮到了2017年。國家藥監局、衛計委陸續出台了一係列政策法規,從內容上主要可以分為三類:醫改政策、藥品審評審批政策和仿製藥一致性評價。影響的幾大主體包括:國內藥企、外資藥企、醫院、CRO、CSO和患者。對抗癌新藥創新這一塊,支持的力度更是前所未有,包括優先審評、簡化審批程序、快速進入醫保等政策的推行將加速創新藥在我國的上市速度,讓創新藥盡快的惠及更多的患者。
憶往昔崢嶸歲月,模式不再可複製
在以上新政實施前,因為中國特殊的藥品審批政策所致,進口新藥在中國的上市往往比國外要晚3-8年,國內的患者因為無法及時使用這些新藥,而錯過了最佳治療的機會,尤其是抗腫瘤藥物,“用的早,用的好”是能最好發揮藥物療效的關鍵因素,例如,在多西他賽用於非小細胞肺癌的使用上,一線使用的有效率幾乎是二線使用的一倍;由於抗腫瘤新藥開發投資巨大,近些年又在不斷上升,所以定價比較昂貴,這是一個限製新藥可及性的關鍵因素,醫保更新速度太慢(間隔至少5年),在日本,新藥上市幾個月就可以進入醫保;在國內,新藥進入醫保的難度很大,進口藥更是難以實現。很多患者根本用不起這樣的高價藥。
在這裏,不得不提到一個很成功的案例,埃克替尼,是首個由我國醫藥企業開發的擁有自主知識產權的小分子絡氨酸激酶抑製劑,上市以後很快打開市場並取得成功(曆年的銷售額見圖1)。上市第二年就達到3.07億元的銷售額,2016年埃克替尼的銷售額高達10.35億元。
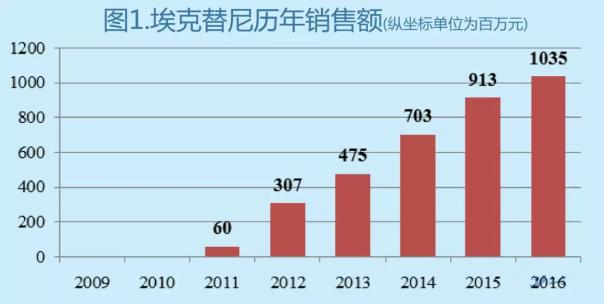
埃克替尼取得的成功,可能有以下幾個原因:
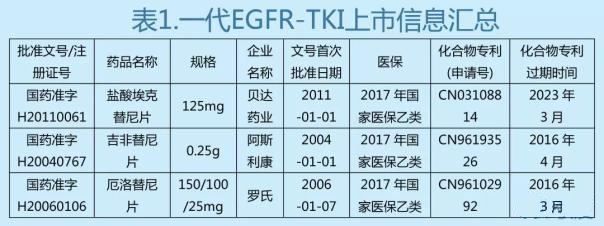
①埃克替尼上市這幾年,吉非替尼和厄洛替尼的專利還尚未到期,三家企業均未受仿製藥競爭帶來的影響。
②從2011至2016年,國內上市的非小細胞肺癌的EGFR-TKI藥物僅有一代藥物吉非替尼和厄洛替尼,二代藥物阿法替尼在2017年4月獲得批準上市,三代藥物奧希替尼在2017年3月被批準上市。沒有麵臨二、三代藥物的競爭,而且,短時間內阿法替尼、奧希替尼還無法影響整個用藥格局。
③公司市場銷售能力強,又具有本土作戰帶來的主場優勢,在2013年被部分省納入醫保目錄,享受國家優惠待遇。
④埃克替尼經過多個大型RCT試驗驗證,包括與吉非替尼的頭對頭研究ICOGEN,證明其療效和安全性不劣於吉非替尼,缺點是需要一日服用三次,依從性不及吉非替尼。又被《中國晚期原發性肺癌診治專家共識(2016年版)》等指南推薦。
從以上的分析我們也可以看到,好品種+好銷售+合適的上市時機三合一因素鑄就了埃克替尼的成功。但成功已經不能複製,2017年以後EGFR-TKI的競爭將更加複雜,由於研究表明二代和三代EGFR-TKI均可以用於EGFR敏感突變的NSCLC患者的一線治療,而且還可以用於一代EGFR-TKI無法治療的其他突變,再加上仿製藥陸續開始上市,未來EGFR-TKI之間的競爭將會十分慘烈,但一代EGFR-TKI具有療效好、價格低、醫保報銷、醫生使用經驗豐富四大法寶,還不會很快失去一線治療的地位。
忽如一夜春風來,千樹萬樹梨花開
早在2015年11月11日,國家局就發布了“國家食品藥品監督管理總局關於藥品注冊審評審批若幹政策的公告(2015年第230號)”,是近幾年第一次針對新藥審批做出較大的改革,共包括10項政策,其中3條政策(第3、7、8條)對創新藥的審批和市場準入、未來的市場發展均有很大的影響。包括:對新藥的臨床試驗申請,實行一次性批準,不再采取分期申報、分期審評審批的方式;加快臨床急需藥品的審批,實行單獨排隊,艾滋病、惡性腫瘤、重大傳染病和罕見病藥品均被列為急需藥品。
而2017年10月10日,《國家食品藥品監督管理總局關於調整進口藥品注冊管理有關事項的決定》(國家食品藥品監督管理總局令第35號)被公示在總局網站上,以往進口藥品在中國進行臨床試驗和上市注冊申請需要在國外批準上市才可以;在中國進行國際多中心藥物臨床試驗,試驗用藥物需要滿足已在境外注冊,或者已進入Ⅱ期或Ⅲ期臨床試驗的要求(預防用生物製品除外);進口藥注冊需要三報三批;這些因素均導致了進口藥物在我國上市要晚於發達國家3-8年。所以,與發達國家相比,我國的用藥結構一直是很落後的。此次調整取消了上述規定,並提出:對在中國進行的國際多中心臨床試驗,允許同步開展Ⅰ期臨床試驗;在中國進行的國際多中心藥物臨床試驗完成後,申請人可以直接提出藥品上市注冊申請;而且同樣適用於該決定發布前已受理、以國際多中心臨床試驗數據提出免做進口藥品臨床試驗的注冊申請,隻要這些申請符合《藥品注冊管理辦法》及相關文件要求的,可以直接批準進口。以上這些政策將加快國外創新藥物進入國內的速度,同時,加劇國內外創新型企業的競爭。
關於優先審評這一塊,早在2015年11月13日,總局就已經發布了《關於解決藥品注冊申請積壓實行優先審評審批的意見(征求意見稿)》,2016年2月26日正式發布《解決藥品注冊申請積壓實行優先審評審批的意見》,2017年12月28日,總局發布《關於鼓勵藥品創新實行優先審評審批的意見》,同時廢止了2016年2月26日正式發布的《解決藥品注冊申請積壓實行優先審評審批的意見》。從內容上看,新舊法規給出優先審評的範圍基本沒變,新的意見僅增加了將實施強製許可的藥品納入優先審評審批的範圍。標題上從“解決積壓”變成“鼓勵創新”,加快具有臨床價值、臨床優勢、臨床急需的藥品上市速度仍是不變的主題。
受以上政策惠及的包括阿法替尼、奧希替尼等進口創新藥,2017年4月,阿法替尼在中國被批準上市,提出注冊申請後,在2016年10月10日被CDE公示獲得優先審評資格,理由是“本品為首個第二代EGFR-TKI,與目前國內已上市的第一代EGFR-TKIs相比,具有明顯的臨床優勢”。阿法替尼是首個“上市申請”獲得優先審評的進口新藥。雖然在阿法替尼的用藥過程中,多數患者需要通過劑量調整來克服(相對於一代EGFR-TKI)本身存在毒性較大的缺點,但其對於EGFR罕見突變的患者很有效。奧希替尼片(AZD9291)在2016年8月提出國內注冊申請,2016年11月3日被CDE公示獲得優先審評資格,2017年3月24日被國家食藥總局批準上市,成為我國新藥審批改革後上市審批時間最短的藥物,也是阿斯利康管線中批準最快的藥物。
小結
從以上的內容我們看到,國家在新藥創新的支持方麵,還是做了大量的工作,尤其是一些有價值的抗癌新藥實現了在短期內批準上市,未來將會有更多有價值的創新藥會駛入CFDA鋪建的快車道。在看到機遇存在時,同時對我國的藥企、CRO、CSO也提出了更高的要求,藥企需要提高項目管理能力和研發創新能力,CRO需提高自己的臨床試驗業務水平,CSO需提高自己的銷售業務水平。
參考文獻:
1.藥渡數據庫
2.CFDA官網
3.CDE官網
4.中國埃克替尼治療非小細胞肺癌專家共識(2016年版)
















 相關新聞
相關新聞