1月31日,美國科學家們帶來了癌症免疫療法領域的一項重大突破!研究發現,將微量的兩種免疫刺激藥物直接注射到小鼠實體腫瘤中,能夠消除小鼠體內所有癌症的痕跡,包括遠處的、未經處理的轉移。更重要的是,這種方法適用於許多不同類型的癌症。
圖片來源:Science Translational Medicine(DOI: 10.1126/scitranslmed.aan4488)
斯坦福大學腫瘤學教授Ronald Levy博士是這篇Science Translational Medicine論文的通訊作者,他也是癌症免疫療法的先驅之一。
事實上,這類新型抗癌療法的種類有很多,其中一些是依賴於刺激全身免疫係統;另一些是通過靶向限製免疫細胞抗癌活性的檢查點;還有一些(如近期被批準用於治療某些類型白血病和淋巴瘤的CAR-T療法)則需要從患者體內分離出免疫細胞,然後經過基因改造使其能夠攻擊腫瘤。雖然這些方法中很多都成功了,但它們都有一些缺點,如難以處理的副作用、費用高、漫長的準備或治療時間等。
Ronald Levy (left) and Idit Sagiv-Barfi led the work on a possible cancer treatment that involves injecting two immune-stimulating agents directly into solid tumors.Steve Fisch
Levy教授說:“所有這些免疫療法的進步正在改變著醫療實踐。我們的方法不同之處是,一次性使用極少量的2種藥物,隻在腫瘤內部刺激免疫細胞,既繞過了‘鑒定腫瘤特異性免疫靶點’的需要,也不必對免疫係統進行大規模的激活,同時不需要對患者的免疫細胞進行定製。在小鼠中,我們看到了這一療法令人驚訝的廣泛效應,包括腫瘤全部消除。”
究竟是哪兩種藥物?
具體來說,Levy教授的方法是通過直接注射微克級(microgram amounts)的兩種藥物到腫瘤部位,從而重新激活癌症特異性T細胞來發揮作用。
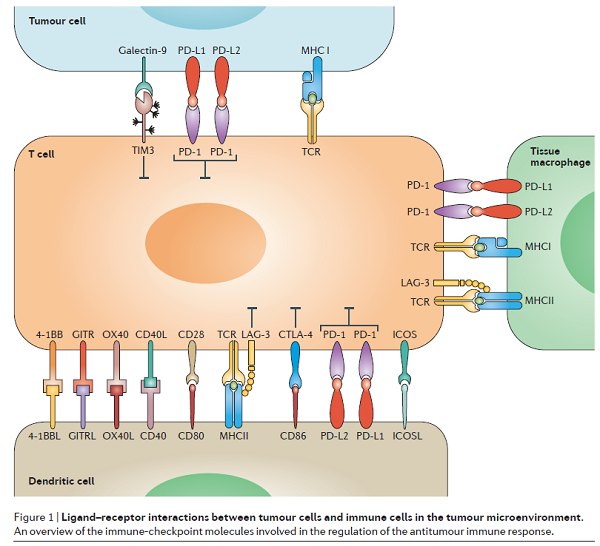
抑製性受體(如CTLA-4、PD-1)的“刹車”功能(作用是抑製T細胞的功能)相反,激活性受體(如CD28、OX40)的作用可比作 “油門”。(圖片來源:Nature Reviews Clinical Oncology)
其中一種藥物是被稱為“CpG寡核苷酸”(CpG oligonucleotide)的DNA短鏈,它與附近其他免疫細胞“攜手”,放大了T細胞表麵上激活性受體OX40的表達。另一種藥物是結合OX40的一種抗體,作用是激活對抗癌細胞的T細胞。
由於這兩種藥物是直接注射到腫瘤中,因此,隻有浸潤到腫瘤中的T細胞才會被激活。其中一些激活的T細胞會離開原發腫瘤部位,尋找和摧毀整個身體中的其他腫瘤。
圖片來源:網絡
87隻小鼠癌症被治愈
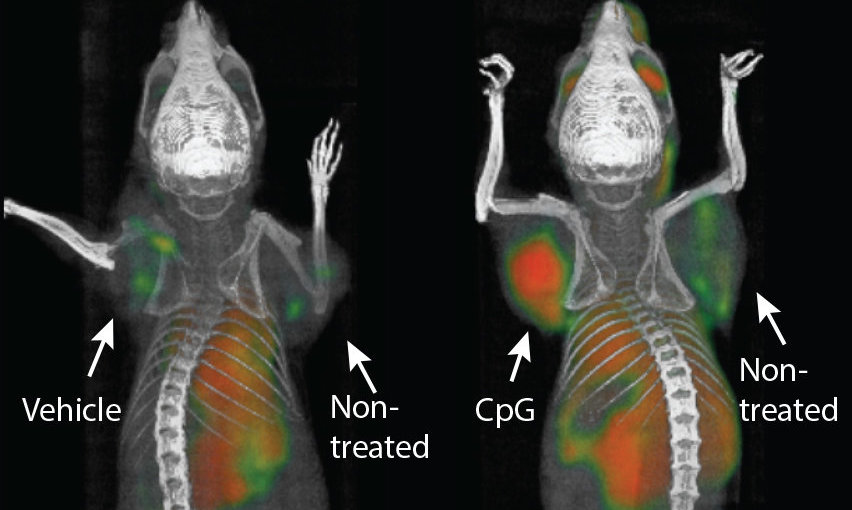
研究證實,這一新型免疫療法在“身體兩處被移植了淋巴瘤的實驗室小鼠”中表現得非常好:向其中一處腫瘤注射以上2種藥物後,不僅使得該處腫瘤消退,另一處未被治療的腫瘤也同樣消退了。利用這種方法,90隻小鼠中,有87隻癌症被治愈了。雖然之後有3隻小鼠癌症複發,但接受第二次治療後,腫瘤再次消退。
科學家們在患有乳腺癌、結腸癌和黑色素瘤的小鼠身上也觀察到了類似的結果。值得一提的是,經基因改造自發患上乳腺癌的小鼠也對療法有響應。
Scientists devised a pinpointed immunotherapy regimen that eradicated tumors throughout the body in mice. Credit: Sagiv-Barfi et al., Science Translational Medicine (2018)
隨後,研究人員還通過將兩種類型的腫瘤同時移植到小鼠身上,進行了特異性調查。論文的第一作者Idit Sagiv-Barfi博士在小鼠的兩個部位移植了相同的淋巴瘤癌細胞,並在第三個部位移植了結腸癌細胞係。結果顯示,治療其中一個淋巴瘤部位使得淋巴瘤腫瘤全部消退了,但並沒有影響結腸癌細胞的生長。
Levy教授說:“這表示,我們的方法是非常有針對性的。隻有共享‘被治療部位所展示的蛋白靶點’的腫瘤才會受到影響。”
圖片來源:斯坦福大學
臨床試驗正在進行中
總結來說,科學家們認為,局部應用極少量的藥物可以作為一種快速且相對便宜的癌症療法,且這種療法不太可能會導致全身免疫刺激常常引發的嚴重副作用。現在,最大的問題是,這一方法能否在人類中同樣奏效。
據悉,研究者們正在開展一項相關臨床試驗,預計招募約15名低級別(low-grade)淋巴瘤患者。如果成功,Levy教授認為,這種療法可能對許多腫瘤類型都是有用的。
















 相關新聞
相關新聞