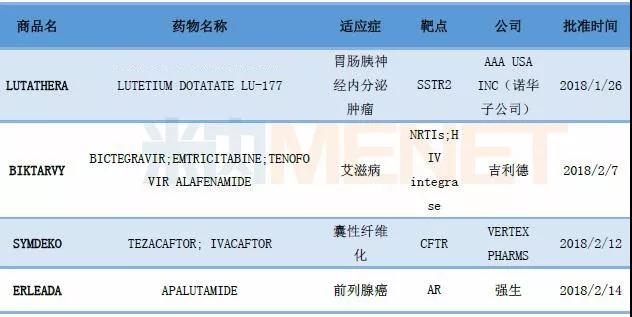
據FDA官網2018年3月1日提供的最新公布結果,FDA在2018年前兩個月陸續批準了4款新藥。
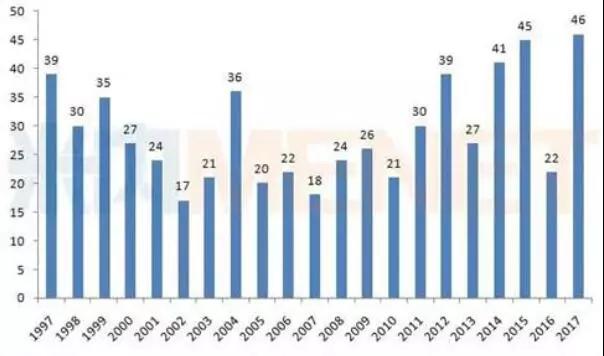
2017年是美國藥物批準的大年,美國食品和藥物管理局(FDA)批準了46種新藥以及兩款CAR-T療法、一款基因療法。2018年也會是批準的大年嗎?目前言之尚早,但目前的趨勢來看,2018年依舊會有較多新藥獲批。
圖1:美國CDER1997-2017年批準的新藥數量
(數據來源:米內網綜合整理)
4款新藥,藥企巨頭依舊是研發主力
表1:2018年1、2月批準的4款新藥
(數據來源:米內網綜合整理)
首款多肽受體放射性核素療法:Lutathera
2018年1月26日,FDA批準了新的一年以來第一款新藥Lutathera。它由諾華(Novartis)集團公司的Advanced Accelerator Applications開發,用於治療生長抑素受體陽性的胃腸胰腺神經內分泌腫瘤(GEP-NETs)。這也是美國FDA批準的首款多肽受體放射性核素療法(PRRT)。
Lutathera此次獲批基於兩項研究。第一項是NETTER-1研究,受試者為229名SST受體陽性的GEP-NET晚期患者。試驗中患者隨機接受Lutathera+奧曲肽治療或奧曲肽單獨治療。與僅接受奧曲肽治療的患者相比,Lutathera+奧曲肽治療患者的中位無進展生存期更長(40個月VS8個月)。第二項是基於一項由1214名SST受體陽性腫瘤(包括GEP-NETS)患者參與的研究數據。在GEP-NETs亞組(360例)有16%的人達到完全或部分緩解。
這項批準為這些罕見癌症的患者帶來了新的治療方案。這也彰顯了FDA願意考慮‘擴大使用’項目中的數據,來支持新療法的批準。
三合一抗艾藥物,吉利德又添一員大將:Biktarvy
2018年2月7日,Gilead Sciences宣布美國FDA批準了其新藥Biktarvy上市,作為每日一次的單片片劑療法,治療HIV-1感染。Biktarvy是一種三合一的複方劑型,由bictegravir(50mg)、emtricitabine(200mg)、與tenofovir alafenamide(25mg)三種成分組成。與Gilead的另一款抗HIV藥物Descovy(FTC/TAF)相比,Biktarvy多了bictegravir(一款全新的整合酶鏈轉移抑製劑INSTI)。
FDA批準Biktarvy後,Leerink Partners分析師Geoffrey Porges評價道,由於該組合的“卓越的安全性和有效性”以及一個包含四個成功的Ⅲ期試驗的數據,被FDA提前批準是毋庸置疑的。且該團隊對Biktarvy抱有極大的信心,預計其將在2018年為Gilead帶來可觀的收益,並將在2021年的銷售中一路攀升至63億美元。
第3款針對囊性纖維化根本病因的藥物:Symdeko
近日,Vertex醫藥公司宣布Symdeko(tezacaftor/ivacaftor和ivacaftor)獲得FDA批準上市,用於治療12歲及以上的囊性纖維化(cysticfibrosis,CF)患者,這些患者的囊性纖維化跨膜傳導調節因子(CFTR)基因攜帶兩個F508del突變拷貝或者至少攜帶一個對tezacaftor/ivacaftor藥物有反應的突變。
Symdeko是Vertex獲得FDA批準的第3種針對囊性纖維化根本病因的治療藥物。囊性纖維化是一種罕見的會縮短壽命的遺傳疾病,影響了北美、歐洲和澳大利亞約75000 名患者,由基因突變導致的 CFTR 蛋白缺陷或缺失引起。
此次Symdeko給更多的患者提供了一種重要的新型治療選擇,能讓更多患者從中獲益。據悉,歐洲藥品管理局(EMA)已經確認了tezacaftor/ivacaftor 組合藥物的營銷授權申請(MAA)。公司預計在 2018 年下半年獲得歐盟批準。
再添重磅抗癌新藥,強生的不斷努力:Erleada
2018年2月14日,FDA批準強生Erleada (apalutamide) 上市,用於治療非轉移性(前列腺癌細胞未擴散)去勢抵抗(激素治療後疾病仍進展)的前列腺癌。Erleada獲得過FDA的優先審評資格,是FDA批準的首個治療非轉移性去勢抵抗前列腺癌的藥物,也是首個憑借無轉移生存期(metastasis-free survival,MFS)的臨床終點獲批上市的腫瘤新藥。
Erleada屬於第二代高選擇性雄激素受體(AR)拮抗劑,與雄激素受體的親和力是第一代AR拮抗劑的5倍以上。強生在2013年8月以10億美元(6.5億美元首付款+3.5億美元裏程金)收購Argon公司將ARN-509(JNJ-56021927, apalutamide)收入囊中,作為對自己前列腺癌產品線的補充。在一項包含了1,207名非轉移性去勢抵抗性前列腺癌患者的3期臨床試驗SPARTAN中,Erleada的療效和安全性在臨床試驗中得到了充分的證實。良好的療效,使得業內對Erleada的市場前景非常看好,預計未來五年銷售額峰值能達到14.5億美元。
結語
創新驅動進步,新藥的獲批意味著患者有更多的治療選擇。隨著國內對藥物研發的重視,各種激勵政策的實施和各大藥企的不斷投入,在各大疾病領域新藥開發中出現了越來越多國內企業的身影。相信隨著國內企業的不斷努力,未來在新藥研發領域也能取得舉足輕重的地位。














 相關新聞
相關新聞