bDNA技術在寡核苷酸及mRNA藥物生物分析中的應用與實例分享
隨著技術的不斷進步,生物醫藥蓬勃發展,藥物形式多變多樣,已經從傳統的化藥、抗體、蛋白、多肽延伸到細胞、核酸等多種形式。新藥物形態的不斷湧現,也對相關的生物分析技術提出了高要求和新挑戰,新型分析技術也不斷被隨之引入。hjc黄金城新媒體的生物分析係列專欄,繼續邀請本領域的資深專業人員從不同的視角筆談生物分析,本期將分享核酸類藥物的別樣分析技術:bDNA。
近年來,核酸藥物迎來了其快速發展的階段。2016年至今,共有 15 款核酸藥物成功在美國和/或歐盟獲批上市,包括 13 款寡核苷酸藥物和2 款 mRNA 疫苗,其中寡核苷酸藥物中 8 款為反義核酸藥物(ASO),5 款為小幹擾核酸藥物(siRNA)。可見,以ASO和siRNA為代表的寡核苷酸和mRNA成為了核酸類藥物研發的熱門細分領域,國內外已有越來越多的寡核苷酸和mRNA進入到了IND或臨床研究階段。
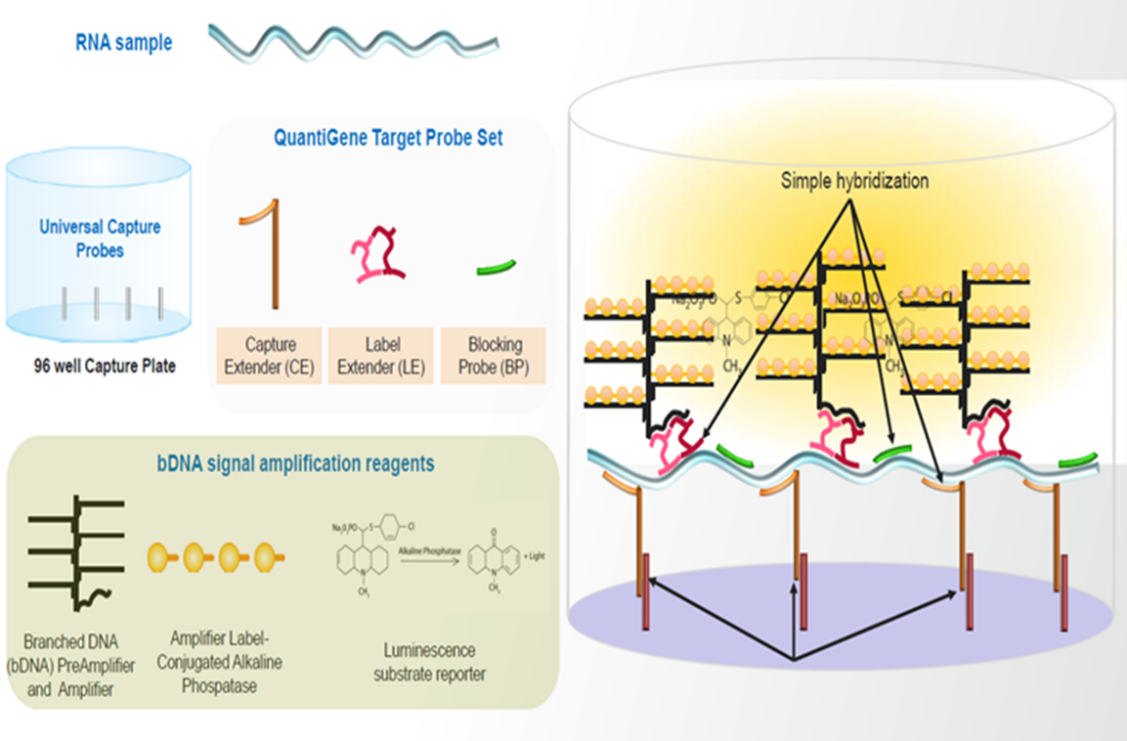
核酸類藥物除了涉及合成修飾、遞送、穩定性及免疫原性等常見的要考慮和克服的問題外,在進入IND和臨床階段也避免不了藥代動力學研究方麵的挑戰,藥代動力學的生物分析方法就是其要麵對的一個很現實的技術性挑戰。對於mRNA來說,極易被核酸酶降解,不穩定,半衰期短,方法需要高度靈敏。雖然RT-qPCR靈敏度很高且可以執行其定量分析,但涉及複雜的核酸提取和反轉錄,且核酸提取過程中會有損失、絕對提取回收率不可控等問題;對於寡核苷酸雖然可以通過修飾等技術手段而使不穩定、半衰期短等情況得以有所改善,但其本身分子量不大不小的特性(一般ASO為18-30nt的單鏈形式,siRNA為20-25nt的雙鏈形式),無論是傳統的小分子分析技術質譜還是傳統的核酸分析技術qPCR對其分析都具有挑戰性,如質譜技術涉及到殘留保留、儀器汙染及靈敏度問題;Stem-loop RT-qPCR的方法雖然可以勉強用於寡核苷酸,但qPCR技術本身其實更加適合於較長的核酸分子,若是修飾的核酸分子則潛在更不適用。除了質譜和qPCR技術外,液相熒光檢測技術及Hybrid-ELISA(hELISA)技術等都在核酸類藥物分析上有所應用。這幾大類技術形成的方法各有優勢,但也各有其劣勢,有的需消耗較高的樣本量,有的靈敏度仍難以足夠高,有的涉及複雜的反應步驟或特殊酶的使用等等局限性。當前還有一種核酸分析技術即bDNA(branch DNA)技術,可以在不同程度上彌補上述各技術的一些不足。bDNA技術即支鏈DNA技術,該技術綜合了分子標記、探針設計、分子雜交、熒光或化學發光檢測於一體的分析技術。該項技術的本質是核酸分子雜交技術的升級版,同樣需要特異性捕獲探針和檢測探針。
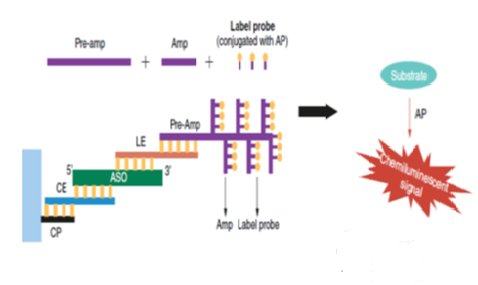
不過此技術中的捕獲探針和檢測探針都帶有額外的延伸序列,捕獲探針可以利用其延伸序列與Assay Plate上預包被的通用捕獲序列互補結合;檢測探針為雙“Z”型特殊結構,其下端與目標分子特異性互補, “Z”型探針上端的延伸部分可以與預放大探針結合,然後由預放大探針、放大探針、標記探針逐步結合構成樹枝狀結構的探針組實現檢測信號的級聯放大,從而達到提高靈敏度的效果【圖1】。對於較短的小核酸,檢測探針的雙“Z”型結構可以用非“Z”型的延伸探針靈活替代,隻要延伸序列可以與預放大探針互補結合即可。由於預放大探針、放大探針、標記探針都是固定的通用序列,分析所用的微孔板可預包被通用捕獲探針,因此這些試劑和耗材可以以試劑盒的形式被商業化提供。目前Thermo旗下的QuantiGene就圍繞bDNA技術提供了較為全麵的配套固定組成的試劑盒產品,其中已經包含了固定組成的信號放大係統和預包被通用捕獲探針的Assay Plate及一些常用試劑,大大便利了科研人員使用這項技術。因此,實踐中隻要針對具體的目標分子設計、篩選和定製好特異性的捕獲探針與檢測探針就可以嚐試利用bDNA技術為自己的目標分析物開發和優化方法。
該技術克服了傳統的Real Time PCR技術中的缺陷與不確定因素,無需抽提純化RNA,無需反轉錄,無需PCR擴增,隻要將樣本用特定裂解液裂解後,經探針雜交與信號放大後即可迅速得到核酸定量結果,每個反應微孔的終末狀態樣本用量才僅20-40微升即可。bDNA技術在化妝品研發、生物醫藥及病毒檢測等領域中均有應用,此技術在國外醫藥研發領域應用較為廣泛,但目前國內醫藥研發領域實際應用甚少。由於其高靈敏度且消耗樣本量少的特點,在臨床前藥代動力學和組織分布研究中,尤其是對於那些特殊給藥、特殊取材,采樣量有限的小動物試驗有著獨特的應用優勢。該項技術可以廣泛應用於ASO,siRNA等各種寡核苷酸以及mRNA的檢測。Moderna公司就曾用此項技術進行其mRNA產品的生物分布研究。hjc黄金城生物技術藥物分析部不僅將該技術成功應用於mRNA產品的分析,而且也成功將其應用到了ASO和siRNA兩大最熱門的寡核苷酸藥物分析中,在國內率先實現了此技術在核酸藥物上的全麵應用。此文將各結合具體實際案例對此技術的應用進行簡要介紹。mRNA是一條單鏈核酸分子,其長度和堿基數相對於ASO和siRNA要大很多。因此在利用bDNA實現mRNA分析時,其有著寡核苷酸不可與其比擬的優勢,因為mRNA長度足夠,因此可以對一個mRNA設計多對雙“Z”探針,Z型探針越多則信號放大倍數更高,靈敏度就更易提高。
對一個mRNA分子,與ASO和siRNA在該技術利用上所考慮的不同點是,除了基於mRNA序列設計特異的捕獲探針和雙“Z”型探針外,還需要設計一些與mRNA互補的封閉探針以防非特異性信號的產生【圖2】。
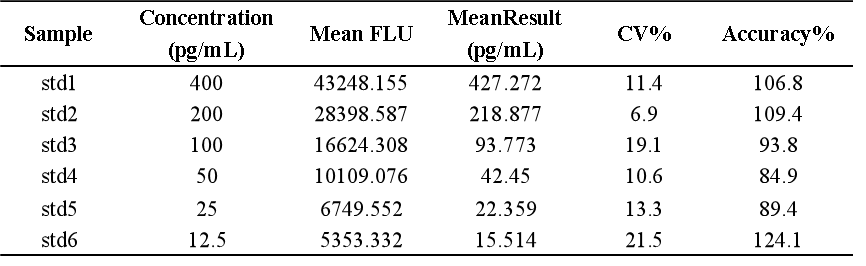
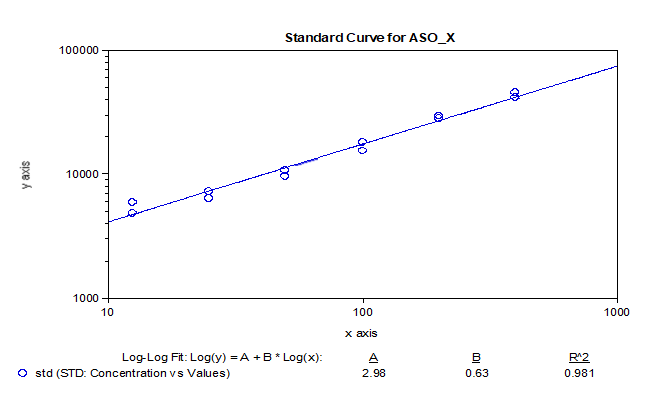
我們基於bDNA技術可以很好地應用於mRNA分析的原理,對某mRNA分子利用bDNA技術開發了其組織分布的分析方法。如下例所示,我們可以利用bDNA技術不僅將組織中mRNA的檢測下限做到小於100copies/uL,而且其準確度和精密度都可以完全滿足LBA技術的法規所要求接受標準。從標準曲線上可以看出,bDNA技術方法中不同濃度標準品的儀器響應信號的倍增與濃度倍增間的關係趨近了理想的正比例關係【表1】,因此可以做到利用一次方程線性擬合【圖3】,因其脫離了抗原-抗體反應關係的利用,故其信號與濃度間的線性關係不同於LBA技術及hybrid-ELISA技術,而後兩者往往要用4參數或5參數的曲線進行擬合。表 1 bDNA檢測某mRNA的標準曲線數據
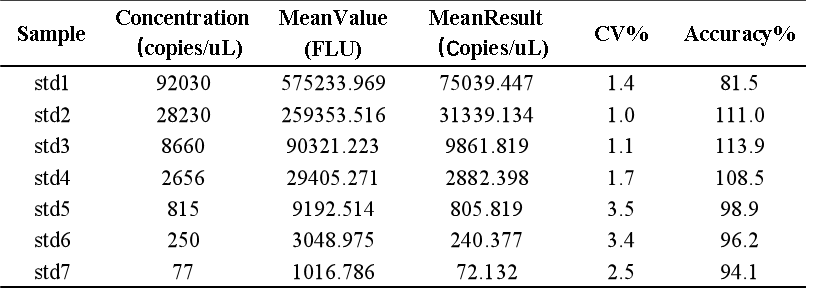
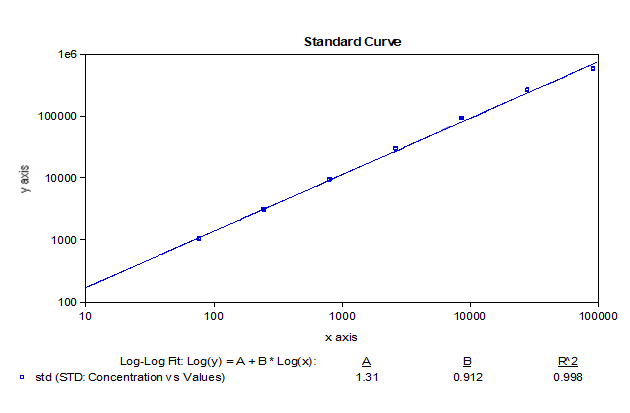
圖3 bDNA檢測某mRNA標準曲線擬合
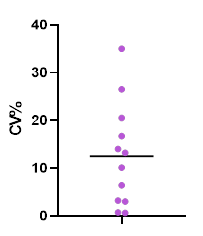
在一項Preclinical study中,第一輪樣品分析中的僅極少部分的組織樣品因需進行了重分析,而重複分析的結果幾乎全部與初次分析結果一致,即90%以上的樣品與初次分析結果一致【圖4】,顯示bDNA技術方法具有良好的重現性。
3. bDNA在反義寡核苷酸(ASO)分析上的應用
bDNA應用於ASO和siRNA時與在mRNA上的應用有所不同,因為前兩者是寡核苷酸,鏈很短而不必要封閉探針,且因為鏈短而也不方便使用雙“Z”型探針,也更不可能使用多個雙“Z”型探針進行信號的放大,一般情況下隻能用非“Z”型的序列延長探針,例如【圖5】所示。因此對於ASO的分析,其難度也相對大於mRNA。
hjc黄金城實驗室也將bDNA實際運用到了血漿中ASO的分析,也獲得令人滿意的靈敏度參見【表2】和【圖6】。雖然其bDNA Assay開發和反應條件探索的過程要比mRNA艱辛複雜。而且基於本實驗室經驗,對於不同的ASO,其反應步驟和反應體係需要靈活變更,雖然目前可以買到含通用探針、Buffer和底物的試劑盒,但不能被其完全局限。
為了適應具體研究的ASO的特性尤其是為避免穩定性和基質幹擾的影響,我們需要針對性摸索和替換一些特殊緩衝液或裂解液成分,這些是通用試劑無法提供的。在靈敏度的實現與提高上,我們也基本上認為對於同樣的一個小核酸分子,bDNA技術較於Hybrid-immnoassays 相對更容易促進Assay的靈敏度。4. bDNA在小幹擾RNA(siRNA)分析上的應用
基於bDNA技術進行siRNA的分析,本質上也是針對其中的一條鏈構建特異性探針和進行信號放大,反應原理圖類似於ASO,因此本文不再單獨用圖展示,仍可參見【圖5】。然而,bDNA在用於構建ASO和siRNA分析方法時也有著很大的區別,ASO是單鏈,而siRNA是雙鏈結構,因此在bDNA技術應用於ASO要相對於siRNA容易實現;siRNA在利用bDNA技術平台構建分析方法時挑戰相對較大,因為siRNA自身雙鏈特征,對於siRNA樣品需要多一個變性的步驟,而變性後又要防止在退火雜交時互補鏈自身的複性結合而影響了捕獲探針和檢測探針與目標鏈的結合,這是不同於單鏈RNA的最大擔憂。
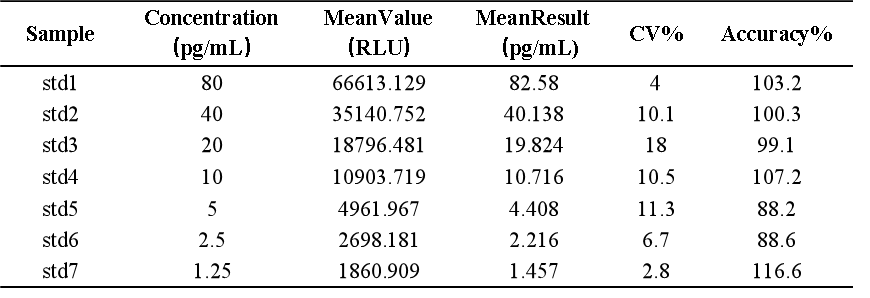
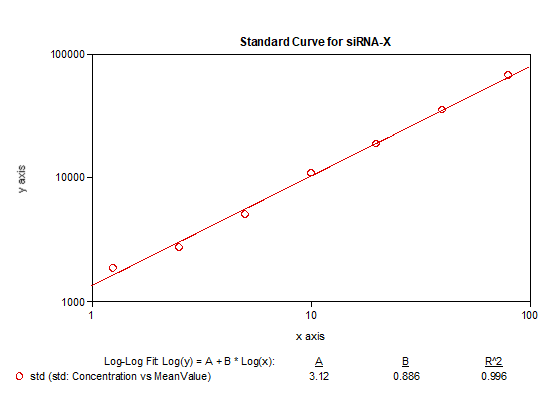
探針序列的選擇和退火孵育溫度的探索非常重要,另外同樣也避免不了穩定性和不同基質的影響,siRNA各反應條件在方法開發中的摸索更加複雜,這些都是此技術應用於siRNA分析實踐中的需要個性化克服的重要的挑戰。一旦這些基本問題得到克服,也可以開發出很高靈敏度的siRNA分析方法,下麵圖表即為hjc黄金城實驗室基於bDNA技術分析血漿中某siRNA的案例展示,如【表3】所示可以做到個位數的pg級靈敏度,無論是ULOQ(80pg/mL)還是LLOQ(1.25pg/mL)各濃度的不同套質控樣品都能達到傳統PK分析方法的回收率接受範圍【圖7】,此靈敏度下的儀器響應值相對不高但仍能執行很好的一次方程線性擬合【圖8】。表 3 bDNA檢測某siRNA-X的標準曲線數據
對於小寡核苷酸,bDNA除了應用於ASO及siRNA以外,還可以用於miRNA和核酸適配體等各種小核酸分子,應用原理與形式總體與前兩者雷同,且miRNA及核酸適配體(一個上市後退市)目前未見正式成藥,也就不在此文贅述。
綜上所述,bDNA技術是一種可以很好的可廣泛應用於各類核酸檢測的技術,無論是長的mRNA,還是短的小寡核苷酸,相較於LC-MS/MS或HRMS及Hybrid-immunoassays等係列技術,其相對更容易提升靈敏度。目前基因治療領域已經有越來越多的核酸藥物使用特殊的局部給藥方式,常涉及到特殊的取材如腦脊液,小動物尿液、甚至還有一些是活檢組織樣品。因此,對相關生物分析也提出了高靈敏度低樣品消耗的更高的現實需求,也是相關醫藥研發工作者的現實需求,bDNA恰是滿足此類需求一種很好的技術。對於mRNA的分析,傳統的RT-qPCR方式雖然可以分析且也有很高的靈敏度,但因核酸的提取步驟繁雜不可能避免抽提過程中核酸的絕對損失,而且不同的提取試劑、人員或提取儀器都會有差異,這些都潛在令qPCR方法的實際靈敏度有所折扣。bDNA技術避免了這些前處理過程的影響,而且可以做到用單位體積目標分析物拷貝數作為其絕對定量單位,且bDNA技術方法一旦開發出來要比qPCR的方法穩健得多,可以用傳統的藥代生物分析的行業技術接收標準來對此類方法進行約束質控。這是其與qPCR技術有顯著區別的地方。基於hjc黄金城生物分析實驗室的全麵應用和體驗,bDNA技術無疑是有顯著優勢和應用價值的適於醫藥研發工業領域的核酸檢測技術。bDNA雖然是一項比較優越的技術,但是實際應用於各類核酸分子分析中並非是可以一蹴而就的,同樣需要較複雜的方法開發和優化過程。同Hybrid-immunoassays一樣,這類技術方法高度依賴特異性探針的設計去成就其方法的特異性,在各類探針齊全的條件下仍然要花費較長的時間和精力摸索反應條件及各類反應緩衝液的配方甚至調整不同探針的反應模式、反應體係和反應順序等係列條件才能開發建立出一套滿意適用的分析方法。正如前文指出,bDNA在被利用於各類型核酸分析中,對於mRNA、單鏈寡核苷酸(ASO)和雙鏈寡核苷酸(siRNA)其應用難度是遞進的,而且每一個類型核酸中具體藥物分子的bDNA方法也都是個性化的,難度因分子本身而異,需要針對具體分子的序列和特點進行分析方法的開發。在生物分析方法開發上,bDNA技術並沒有比其它類型方法顯著節省時間和精力,而且bDNA技術因其探針結構特殊性,該方法的應用成本要高於其它核酸分析技術。然而,一旦基於bDNA技術原理的方法開發成功,則具有非常可靠的穩健性和重現性。bDNA技術還可以執行多重檢測,其所涉及到的雙“Z”型探針或其它延伸探針及信號放大係統不僅可以直接用於核酸的檢測,還可以拓展到其它的分析檢測平台上。Thermo公司就將這類探針技術運用到流式平台針對細胞層麵的轉錄本檢測中,固定並破膜的細胞可直接與特異的延伸標記探針孵育基於信號放大係統進行信號放大,最後被流式檢測,此技術被命名為PrimeFlow RNA分析技術。除了在流式平台的拓展應用外,雙“Z”型探針及信號放大係統還可以被組織細胞的目標RNA原位雜交RNAscope技術所應用,從而使RNA原位雜交具有高度特異性、提高單分子檢測的敏感性並帶來極高的信噪比,能夠在單細胞水平同步定量多個RNA的表達,在獲得單細胞中單拷貝RNA表達數據的同時提供完整的組織形態學信息,這也是小核酸研發領域基於組織學水平考察藥物分布所需要的技術。盡管目前在國內醫藥研發領域bDNA技術的應用相對較少,但隨著基因治療藥物尤其是其分支領域核酸類藥物的蓬勃發展, bDNA將會逐步走入廣大研發人員視野,該技術的性能將被越來越多的人認知和認可。

分享到:


















 相關新聞
相關新聞