2020年2 月 2 日,英國藥品監管部門緊急批準了BioNtech與Pfizer公司合作研發的 COVID-19 mRNA 疫苗 BNT162b2,這是曆史上第一個獲批上市的mRNA疫苗;
2022年2月25日,Moderna公布2021年Q4財報和全年業績報告,得益於mRNA新冠病毒疫苗的上市和銷售,Moderna2021年營業收入185億美元,淨利潤122億美元。

新冠病毒的全球流行使mRNA疫苗在市場大獲成功,推動了核酸藥物的研發及技術平台的發展及成熟,向全球醫藥行業初步展現了它的潛力和能量,成為生物技術第三次革命的一大支柱點。

△截至目前全球已獲批的核酸類藥物列表 (數據來源:科睿唯安)
生物技術的三次革命體現了生命科學的多層次調控,靶向中心法則的不同環節催生了藥物研發的差異化策略。以往的技術革新已經在藥物的靶向性,靶點的多樣性方麵進行了卓越的進步,而核酸藥物區別於以往技術最大的優點便是可以基於堿基序列快速直觀的設計,利用簡單的製備原料和工藝,可負擔的生產成本,讓藥物研發的周期大幅縮短,讓藥物定製或個性化治療方案成為可能,使罕見病等困擾目前醫藥行業的棘手問題得以解決。這樣的藥物設計策略也形象地被稱為程序化製藥(Programmable
medicine)。
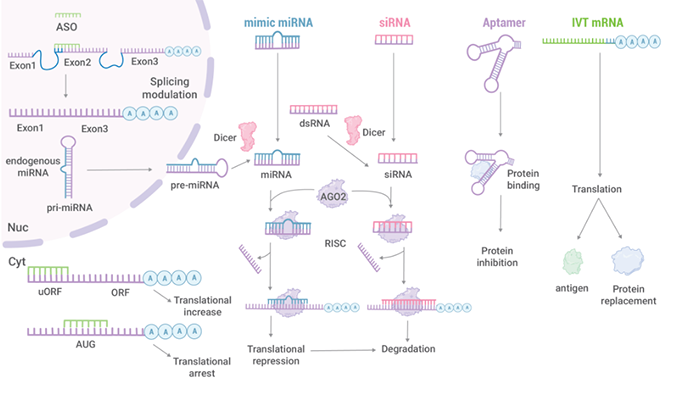
△圍繞著中心法則,核酸藥物的研發策略形成差異化。【1】
程序化製藥用直截了當的編程思維為解決複雜玄妙的生命科學提供了一把開山斧,而使之成為可能的,是CRISPR/Cas9 係統的發現和應用。Crisper/Cas9係統是是一種高效可控的DNA剪切工具,Cas9 蛋白被引導 RNA
分子所激活,發揮識別和切割基因組 DNA 的功能。核酶是具有催化活性的 RNA,可降解特異的 mRNA 序列。利用具有特定序列的核酸作為藥物打破了傳統藥物治療方法隻能作用於靶蛋白的方式。這些核酸藥物的候選靶點豐富,適應症分布廣。

△Crispr/Cas9可以像一把剪刀一樣,對特定的基因序列進行敲除,從而達到基因編輯的效果。
可是,人體終究不是簡單的二進製程序,在程序化藥物付諸實踐的途中,科研工作者們發現有重重阻礙需要克服。因為人體結構複雜,有多種不同的機製相互牽連,共同維持身體的和諧穩定,抵禦外來物質的入侵。
而人體對於核酸就很不友好。首先,核酸分子半衰期短,且易被腎髒吸收清除,在人體內的穩定性差;第二,血液中的多種核酸酶可以輕易將核酸降解;第三,核酸物質會激活一些免疫識別受體如TLR3/7/8,造成免疫原性反應;第四,由於核酸通常分子量較大,且攜帶負電荷,所以很難通過膜結構被細胞吸收,讓藥物順利達到靶點位置發揮藥效作用;第五,具有相對完整藥代動力學(ADME)數據的核酸藥物相對較少,其結構的特殊性要求對藥代動力學的方法開發要進行創新和改變;最後,與基因和遺傳物質相似而使人擔憂的潛在副作用……
為了賦能核酸藥物和程序化製藥,核酸藥物的研發也催生了很多新技術。hjc黄金城在這場革命中也加緊布局,目前已形成完整的核酸藥物研發平台,以迎接核酸藥物研發可能帶來的挑戰和難題。
1核酸的化學修飾技術
核酸的化學修飾主要包括堿基、糖環和連接基團磷酸的改造,從而克服核酸藥物在血液中不穩定,半衰期短等劣勢,並加強某些優勢和功能。例如,
化學修飾(2'-F、2'-OMe和2'-MOE等)的摻入大大提高了核酸的穩定性和整體半衰期;
增強靶標親和力
提高生物利用度
硫代磷酸化降低腎髒清除率
在核酸藥物的發現研究階段,我們可以幫助客戶完成各種單體和寡聚體的合成和化學修飾,並完成靶點和早期藥代動力學的各項高通量篩選,得到靶向性好,穩定性佳的核酸化合物。
單體合成
糖修飾
堿基修飾
骨架修飾
寡核苷酸合成
siRNA
ASO/gapmer
寡核苷酸偶聯物合成
2核酸的藥物遞送技術
藥物遞送係統的革新對核酸藥物的發展是意義重大的一步,它使得麵臨人體原本脆弱的核酸分子安全的被送入靶標位置,能夠順利的結合靶點發揮作用。這得益於脂質納米顆粒(LNP)和GalNac偶聯技術的日益成熟,脂質納米顆粒通常由陽離子脂質、膽固醇、PEG化脂質和磷脂組成,有助於掩蓋核酸攜帶的電荷,保護其不被核酸酶降解。化學修飾同樣可以幫助提高核酸遞送的遞送效率。
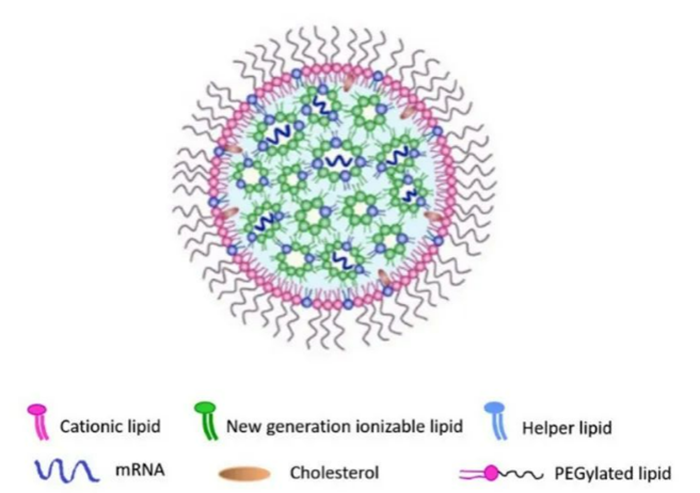
△圖示為核酸脂質納米顆粒的結構。【3】
3核酸藥物的生物分析
核酸藥物雖然進行了一些化學修飾,並且小核酸藥物大多是通過化學合成,但是其基本構造和理化性質還是與體內的核酸物質有著很多相似性,因此會不同程度的在機體內產生生物學效應,對藥物在體內的藥理藥效、代謝和毒性等一係列表現產生深遠的影響。在核酸藥物的臨床前研究中,生物分析是必不可少的一個環節。
一方麵,生物分析要解決的問題是如何在給藥後在體內定量的問題。由於治療性寡核苷酸的目的是改變生物靶點,因此必須能夠準確地確定其在生物樣品中的濃度,還需要確定體內產生的代謝物,代謝物具有潛在活性並可能引起脫靶毒性。核酸藥物的組織分布也很重要。許多治療性寡核苷酸要麽在其結構中構建了靶向部分,要麽將使用傳遞係統來促進藥物進入靶標,以增加其在特定器官中的濃度。這些生物藥物的修飾(如硫代磷酸化、與N-乙酰半乳糖胺(GalNac)偶聯等)不僅提高體內穩定性、靶向特異性和總效價等,同時也給磷酸藥物的分析也帶來了更多的挑戰和機遇。
另一方麵,核酸藥物具有潛在的免疫原性,因此分析核酸化合物與機體可能產生的免疫學效應也是研究工作必須完成的。

△核酸藥物生物分析需要完成的項目及涉及的試驗設備
4
核酸藥物的臨床前評價研究
核酸藥物研究的進展和突破為更多疾病,尤其是遺傳代謝病等慢性疾病帶來了治療的曙光。當我們在臨床前階段去評價核酸化合物的成藥性、安全有效性時,需要關注上述提到的諸多問題,利用多個技術平台,如動物藥效模型平台、質譜分析平台、免疫原性分析平台、細胞生物學平台以及分子生物學平台等的深度交叉合作,提供深入完善的藥物數據,為核酸藥物的研究進程打下堅實的基礎。
5一個彩蛋
核酸藥物勢不可擋,為了更好地助力行業發展,hjc黄金城將聯合一部分行業內核酸藥物的領跑企業於2022年07月開展一場關於核酸藥物的線上論壇,雲集醫藥行業的專家學者,共同展開核酸藥物研發及應用的激烈討論,從藥企和CRO的視角,共話核酸藥物。我們將圍繞以下問題展開報告和討論:
1、驅動核酸藥物新格局的內在原因究竟是什麽?
2、核酸藥物的優勢集中體現在哪裏?
3、基於目前研究,核酸藥物的適應症是否有明確的指向性?
4、核酸藥物的早期研究需要克服哪些壁壘?
5、核酸藥物的生產有哪些環節值得關注?
6、如何保證核酸藥物的安全及有效?
7、核酸藥物在未來十年的前景預測
……
請各位持續關注,精彩即將展開!

參考文獻:
【1】Mollocana-Lara EC, Ni M, Agathos SN, Gonzales-Zubiate FA. The infinite possibilities of RNA therapeutics. J Ind
Microbiol Biotechnol. 2021;48(9-10):kuab063.
【2】Aldosari et al., (2021). Lipid Nanoparticles as Delivery Systems for RNA-Based Vaccines. Pharmaceutics,
https://doi.org/10.3390/pharmaceutics13020206.



















 相關新聞
相關新聞