
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com





PI3K (The phosphatidylinositol3-kinase)是PI3K-Akt-mTOR信號通路的重要組成部分,在細胞的生長、分化、凋亡等方麵都發揮著重要作用。PI3K-Akt-mTOR信號通路的很多成員分子,都是癌症、免疫等過程中的關鍵性藥物靶點。而靶向於PI3K信號通路中關鍵節點的不同類型的抑製劑目前正處於各自不同的臨床研究階段,用以治療人體惡性腫瘤。
PI3K靶點的概括及其轉導通路
PI3K本身具有絲氨酸/蘇氨酸激酶的活性,也具有磷脂酰肌醇激酶的活性。PI3K根據其結構和底物的特異性不同可分為Ⅰ型、Ⅱ型和Ⅲ型。其中,Ⅰ型PI3K是目前研究最深入、最廣泛的亞型,其與腫瘤的關係也最為密切,已成為腫瘤治療的重要靶標。PI3KⅠ型為異源二聚體,由p85的一個調節亞基和一個催化亞基(分為四種結構,即p110α,β,δ,γ)組成,其中調節亞基又含有SH2和SH3結構域,能與含有相應結合位點的靶蛋白相作用。PI3Kα,β異構體表達於多種組織中,δ亞型特異性表達於粒性白細胞中,PI3Kγ則在心血管係統的許多細胞中表達。
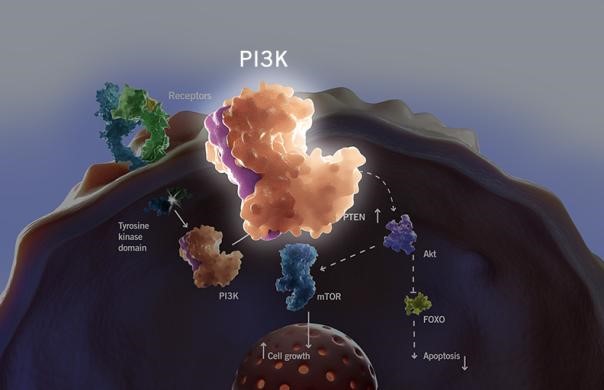
PI3K作為PI3K-Akt-mTOR信號通路的上遊分子,其異常激活可引起一係列反應。當上遊的G蛋白偶聯受體或酪氨酸激酶激活時,PI3K的調節亞基p85被募集到質膜附近,催化磷脂酰肌醇-4,5-二磷酸(PIP2)磷酸化形成脂酰肌醇-3,4,5-,三磷酸(PIP3)[1];PIP3可與蛋白激酶B(AKT)的N端PH結構域結合,使AKT轉移至細胞膜上[2]; 在3-磷酸肌醇依賴性蛋白激酶1(PDK1)的協助下,PI3K通過使AKT蛋白上的絲氨酸磷酸化位點和蘇氨酸磷酸化位點磷酸化而使其激活[3]。活化的AKT可以通過抑製糖原合成激酶3(GSK3)以穩定細胞周期素D1從而調節細胞周期;也可通過抑製Bad(BCL2細胞死亡受體拮抗劑),對抗細胞凋亡[4];還可增加核轉錄因子NF-kB的轉錄活性,從而增加腫瘤細胞的運動能力,促進腫瘤轉移。活化的AKT通過磷酸化作用激活mTOR、GSK3以及BCL-2等信號通路,從而對細胞生長和細胞周期具有非常重要的調節作用。
PI3K抑製劑的研究現狀
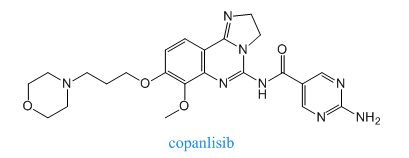
2017年9月14日,美國FDA加速批準Bayer Healthcare Pharmaceuticals的Aliqopa (Copanlisib)上市,用於治療罹患複發性濾泡性淋巴瘤。Copanlisib是PI3K抑製劑,它能抑製PI3K-α和PI3K-δ兩種激酶亞型,其療效也在臨床試驗中得到了驗證。在臨床試驗中,接受Copanlisib治療的患者,緩解率達到了59%,基於臨床試驗的出色數據,美國FDA曾授予這款新藥優先審評資格。
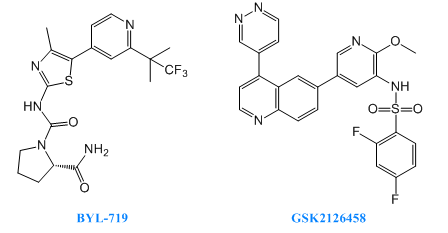
2018年8月23日,諾華製藥宣布其關於BYL719的全球臨床3期試驗獲得了積極的結果,該項研究中YL719是一種有效的選擇性的PI3K-α抑製劑,用於治療乳腺癌。
GSK2126458(Omipalisib)目前處在臨床一期研究階段,用於治療特發性肺纖維化、實體瘤和淋巴瘤。GSK2126458是一種高選擇性,有效的PI3K抑製劑,可以抑製p110α/β/δ/γ,mTORC1/2的活性。
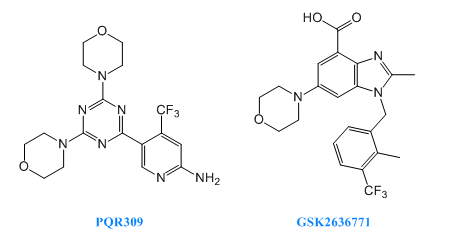
PQR-309處於臨床二期,用於治療淋巴瘤。其用於治療乳腺癌的研究處於臨床一期和二期,用於治療實體瘤的研究處於臨床一期。PQR309是PI3K抑製劑,抑製PKB和S6磷酸化。
GSK-2636771由葛蘭素史克研發,處於臨床二期,用於治療晚期實體瘤。其與恩紮魯胺聯合用藥用於治療轉移性前列腺癌的研究,處於臨床一期。GSK2636771是一種有效的、選擇性的、可口服的PI3K-β抑製劑。
PI3K的研最新研究進展
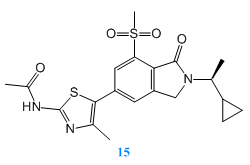
Nils Pemberton等人在最近發表的文章[5]中提出化合物15具有優良的亞型選擇性和良好的藥代動力學和體外安全性,作為PI3K-γ抑製劑有成藥的可能性,值得進一步的研究。
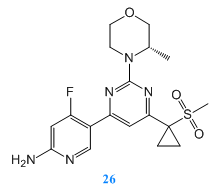
Side Shen等人[6]設計並合成了一係列6-氨基吡啶基4-磺酰2-嗎啉嘧啶核類似物作為PI3K抑製劑進行研究。通過分析研究,成功得到化合物26,其表現出對PI3K-α,β,δ,γ都有較高的抑製作用,並有優良的藥代動力學參數。
Tao Yu等人[7]通過對一係列吡啶嘧啶酮衍生物的鑒定和先導優化,發現了化合物31,其為新型的高效雙靶點(PI3K/mTOR)抑製劑。化合物31對PI3K-α和mTOR有較高的酶活性,具有良好的藥代動力學特性。此外,化合物31在PC-3M腫瘤異種移植模型中顯示了較好療效。

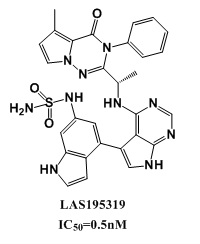
治療呼吸道疾病,抑製劑如果通過吸入方式用藥可直接送達病變位置,能夠提高藥物的治療效果,並減少藥物的副作用。Montse Erra等[8]發現並優化了LAS195319作為吸入式的PI3K-δ抑製劑用於治療嚴重的哮喘和慢性阻塞性肺病。
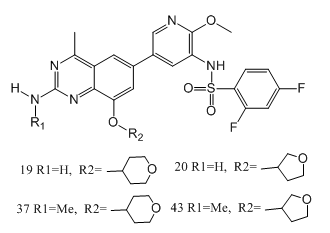
磷脂酰肌醇3-激酶(PI3K)異常激活是癌症中最常見的改變之一,這使得我們努力開發針對PI3K的癌症治療方法。在這項工作中,SongwenLin等人[9]通過雜交和支架跳躍方法發現了一係列新的2-氨基-4-甲基喹唑啉衍生物,它們是高度有效的Ⅰ類PI3K抑製劑。先導物優化產生了一些有前途的化合物(如,19,20,37和43),具有顯著的抗腫瘤增殖活性。另外,與19和20相比,37和43在原位膠質母細胞瘤異種移植模型中顯示出了更好的腦滲透和體內療效。此外,SongwenLin等人還進行了初步的安全性評估,包括hERG通道抑製、AMES、CYP450抑製和單劑量毒性,以表征其毒理學特性。
隨著越來越多的PI3K抑製劑在臨床上取得突破性進展,開發新型小分子PIK3抑製劑已成為該領域的研究熱點,但PI3K抑製劑作為單藥或者聯合用藥的療效和安全性有待進一步的臨床驗證。從目前情況看,大部分PI3K抑製劑的治療效果還不能完全滿足臨床需求,長效PI3K抑製劑應用於癌症治療時對血糖調節、免疫功能等方麵的影響仍有待進一步研究。而新型、高效、低毒的PI3K抑製劑的開發將會成為未來幾年該領域的研究進展。
參考文獻:
1, Franke T F, Kaplan D R,Cantley L C. PI3K:downstream AKTion blocks apoptosis. Cell, 1997,88(4):435-437.
2, Kong D, Yamori T. Advancesin development of phosphatidy linositol 3-kinase inhibitors. Curr Med Chem,2009,16(22):2839-2854.
3, Vanhaesebroeck
B, Guillermet-GuibertJ, Graupera M. The emerging mechanisms of
isoform-specific PI3K signaling. NatRev Mol Cell
Biol,2010,11(11):329-341.
4, Wendel H G, De Stanchina E,Fridman J S. Survival signaling by Akt and EiF4E in oncogenesis and cancertherapy. Nature, 2004, 428(6980):332-337.
5, Nils Pemberton, MickaelMogemark, Susanne Arlbrandt, Peter Bold, Rhona J. Cox, Cristina Gardelli, NeilS. Holden, Kostas Karabelas, Johan Karlsson, Sarah Lever, Xueshan Li, HelenaLindmark, Monica Norberg, Matthew W. D. Perry, Jens Petersen, Sandra RodrigoBlomqvist, Matthew Thomas, Christian Tyrchan, Annika Westin Eriksson, PavolZlatoidsky, and Linda Öster. Discovery of Highly Isoform Selective OrallyBioavailable Phosphoinositide 3-Kinase (PI3K)-γ Inhibitors. J. Med. Chem, 2018,61 (12), pp 5435–5441.
6, Sida Shen, Xiangyu He,Zheng Yang, Liang Zhang, Yingtao Liu, Zhiyuan Zhang, Weiwei Wang, Wei Liu, YufengLi, Dong Huang, Kai Sun, Xiaojing Ni, Xu Yang, Xinxin Chu, Yumin Cui, Qiang Lv,Jiong Lan, and Fusheng Zhou. Discovery of an Orally Bioavailable Dual PI3K/mTORInhibitor Based on Sulfonyl-Substituted Morpholinopyrimidines. ACS Med. Chem.Lett, 2018, 9 (7), pp 719–724.
7, Tao
Yu, Ning Li, ChengdeWu, Amy Guan, Yi Li, Zhengang Peng, Miao He, Jie
Li, Zhen Gong, Lei Huang, BoGao, Dongling Hao, Jikui Sun, Yan Pan, Liang
Shen, Chichung Chan, Xiulian Lu,Hongyu Yuan, Yongguo Li, Jian Li, and
Shuhui Chen. Discovery ofPyridopyrimidinones as Potent and Orally Active
Dual Inhibitors of PI3K/Mtor.ACS Med. Chem. Lett, 2018, 9 (3), pp
256–261.
8, Montse
Erra, JoanTaltavull, Francisco Javier Bernal, Juan Francisco Caturla,
Marta Carrascal,Lluis Pages, Marta Mir, Sonia Espinosa, Jordi Gracia,
Mara Domnguez, Mar Sabat,Stephane Paris, Monica Maldonado, Begoña
Hernandez, Monica Bravo, Elena Calama,Montserrat Miralpeix, Martin D.
Lehner, and Marta Calbet. Discovery of a NovelInhaled PI3Kδ Inhibitor
for the Treatment of Respiratory Diseases. J. Med.Chem. 2018, 61, 21,
9551-9567.
9, Songwen Lin, Chunyang Wang,Ming Ji, Deyu Wu, Yuanhao Lv, Kehui Zhang, Yi Dong, Jing Jin, Jiajing Chen,Jingbo Zhang, Li Sheng, Yan Li, Xiaoguang Chen, and Heng Xu. Discovery andOptimization of 2-Amino-4-methylquinazoline Derivatives as Highly PotentPhosphatidylinositol 3-Kinase Inhibitors for Cancer Treatment. J. Med. Chem,2018, 61 (14), pp 6087–6109.
 相關新聞
相關新聞