
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




HIV是一種會攻擊人體免疫係統的病毒,主要攻擊目標是人體免疫係統中最重要的CD4T淋巴細胞,並大量破壞該細胞,使人體逐漸喪失免疫功能,從而導致人體易於感染各種疾病,甚至發生惡性腫瘤,且病死率較高。目前,全球約有3670萬艾滋病病毒感染者,每年大約有110萬人死於艾滋病,而新發感染者大約每年有210萬。
作為G蛋白偶聯因子超家族(GPCR)成員的細胞膜蛋白,趨化因子受體CCR5是HIV-1入侵機體細胞的主要輔助受體。CCR5抑製劑藥物與CCR5結合後,使CCR5構象發生變化,阻斷了HIV-1與細胞膜蛋白結合,導致HIV-1與CCR5在細胞表麵結合的數量減少,從而起到抗感染作用。因此,CCR5可視為抗HIV-1藥物的篩選靶點,值得廣泛關注並進行細致研究。
關於AIDS和CCR5 的小百科
人類獲得性免疫缺陷綜合征(簡稱艾滋病,AIDS)在1981年被首次發現,25年以來,作為人類曆史上最致命的流行病之一,HIV一度被認為是死刑。隨著研究發展,AIDS已經成為一種可控製的疾病,但是仍無有效治愈手段。
趨化因子是一類具有趨化活性的小分子細胞因子,屬於G蛋白偶聯受體家族。它的功能在於使細胞表麵具有跨膜G蛋白偶聯受體的細胞聚集在一起,參與體內的免疫平衡作用。趨化因子受體CCR5,是人體細胞表麵的一種蛋白受體。早在1996年,科學家就發現,CCR5和另一種蛋白CXCR4是艾滋病病毒HIV-1進入人體細胞的主要入點。其中,利用CCR5侵入細胞的病毒株稱為R5嗜性,利用CXC4侵入的稱為X4嗜性。不同的感染時期,HIV的嗜性也有變化,一般在感染初期為R5嗜性,隨著感染的加深向X4嗜性轉化。
CCR5是由352個氨基酸組成,在結構上分為胞外N端,3個胞外環,三個胞內環,7個跨膜α螺旋和胞內C端,其同源配體包括CCL3、CCL4和CCL3L1。CCR5是細胞內β趨化因子(RANTES、MIP1α和MIP1β)的受體,具有調控T細胞和單核細胞、巨嗜細胞的遷移、增殖與免疫的功能,主要表達在T細胞,巨噬細胞、樹突狀細胞、嗜酸性粒細胞、小膠質細胞和乳腺或前列腺癌細胞的族群中[1]。
CCR5在HIV侵入人體過程中扮演的角色
HIV分為HIV-1和HIV-2兩種亞型,HIV-1致病力強,人類獲得性免疫缺乏症(AIDS)主要是由於被HIV-1病毒感染,其能在體內快速繁殖而導致宿主免疫細胞的大量破壞所致。在 HIV-1 進入白細胞過程中,結構正常的 CCR5 蛋白質起到促進 HIV-1入胞的通道蛋白的功能。
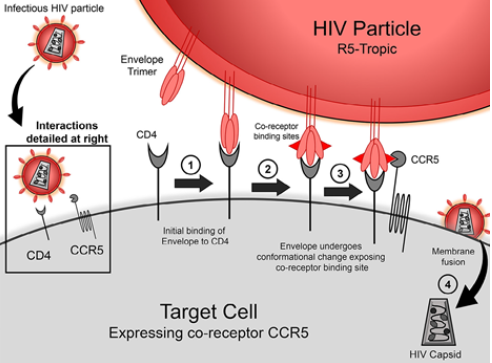
HIV-1進入靶細胞內部,導致細胞損壞死亡,從而降低機體的免疫力是一個複雜的過程:
在HIV-1侵入靶細胞時,首先會發生的是病毒表麵的囊膜蛋白gp120與靶細胞表麵的CD4+ T分子相互作用,致使gp120的V3可變環區暴露。
隨後在趨化因子受體CCR5或CXCR4的進一步的協助下,受體N-末端的酪氨酸和其它一些酸性的氨基酸會相應的黏附到gp120蛋白暴露的V3區上,與病毒的gp120/CD4形成複合體。
接下來,病毒的跨膜蛋白gp41會發生一係列的構象變化,其自身會形成螺旋六聚體結構,促使gp41蛋白分子的N端疏水區向著胞膜方向移動,進而與靶細胞融合。
當HIV-1成功與靶細胞融合後會導致細胞死亡和被破壞,而HIV-1病毒會從細胞內出來,再次通過其他CD4+ T細胞上的CCR5受體進入其他正常的細胞。這樣周而複始,就使體內CD4+ T免疫細胞的數量越來越少,機體的免疫力也逐漸下降,逐漸發展成為艾滋病,並出現很多的機會感染或生成腫瘤,從而致使人體死亡。
由於HIV-1病毒在與靶細胞結合後會使得人體的免疫力降低,使得人體有更多的可能性會感染腫瘤,因此阻斷CCL5-CCR5通路會起到一定的抗腫瘤作用,其兩個抗腫瘤機製分別是:
機製1:促進巨噬細胞M2亞型到M1型轉換。一般在腫瘤組織周圍會有很多巨噬細胞浸潤,這些大量的腫瘤相關巨噬細胞(TAM)也叫M2型巨噬細胞,它們通常沒有殺傷腫瘤細胞的作用,反而會釋放很多趨化因子和細胞因子促進腫瘤生長和轉移。當CCR5抑製劑阻斷CCL5-CCR5通路後,M2型促進腫瘤生長的巨噬細胞就會轉化成具有一定殺傷腫瘤細胞能力的M1型巨噬細胞。
機製2:免疫調節和改變腫瘤周圍的炎性微環境。CCR5抑製劑盡管不會直接殺傷腫瘤細胞,但阻斷CCR5通路後,刺激腫瘤生長的趨化因子和細胞因子都會下調,腫瘤周圍的炎性微環境也會改善;同時,腫瘤周圍的保護性間質會減少,表皮向間質轉化能力也會下降。這種對腫瘤周圍環境的影響,可以幫助免疫檢查點抑製劑或化療藥物更好地殺滅腫瘤細胞。
趨化因子受體CCR5在病毒感染靶細胞過程中起到非常關鍵的作用,而在一些發生CCR5突變的人群中,CCR5的基因序列缺失突變,第185個氨基酸後的32個氨基酸全部缺失,這導致CCR5不能正常表達於細胞表麵,從而可以阻滯HIV的侵入,使得CCR5突變的人群會對HIV病毒有免疫作用。由此可見,阻斷該受體的功能是一個新穎、合理的治療HIV手段。
已報道的CCR5抑製劑總結
病毒入侵過程是一個級聯的結合與構象變化反應,根據病毒入侵複製裂解的不同階段,拮抗劑可分為病毒入侵拮抗劑(如CD4拮抗劑、輔助受體拮抗劑)、逆轉錄酶拮抗劑、融合拮抗劑、整合酶拮抗劑、蛋白酶抑製劑等。目前得到美國食品與藥品監督管理局(FDA)批準的抗HIV-1藥物已有30多種,其中17種是逆轉錄酶抑製劑(包括13種核苷類逆轉錄酶抑製劑及4種非核苷類逆轉錄酶抑製劑),11種蛋白酶抑製劑,1種CCR5受體抑製劑(maraviroc),1種整合酶抑製劑(raltegravir)以及1種融合抑製劑(T20)。
雖然已經有了很多種HIV抑製劑的研發上市,但卻仍未發現一種治療艾滋病的特效藥。雞尾酒療法,是在1996年由美籍華裔科學家何大一提出,是通過三種或三種以上的抗病毒藥物聯合使用來治療艾滋病。該療法的應用可以減少單一用藥產生的抗藥性,最大限度地抑製病毒的複製,使被破壞的機體免疫功能部分甚至全部恢複,從而延緩病程進展,延長患者生命,提高生活質量。
在HIV抑製劑中,病毒入侵拮抗劑中的CCR5抑製劑受到廣泛的關注。其作為抗HIV-1病毒感染的靶點,主要是基於其兩方麵的作用:一是通過阻斷CCR5與gp120之間的相互作用阻斷病毒的感染;二是通過降低或敲除靶細胞表麵CCR5的表達量,進而阻斷病毒的感染。以CCR5為靶點的HIV-1受體拮抗劑越來越受關注,主要有趨化因子衍生物、非肽類小分子化合物、單克隆抗體、肽類化合物等4類。目前已有幾種CCR5抑製劑正處於臨床前和臨床試驗中。
1,已上市的CCR5拮抗劑Maraviroc。Maraviroc的作用機製是能夠占據病毒囊膜蛋白gp120與CCR5的結合位點,使得病毒與CCR5直接作用的機率降低,可以有效的抑製病毒與該受體的結合。Maraviroc的細胞毒性研究發現無不良影響,對CCR5具有高度選擇性,在2007年8月被美國FDA批準用於臨床治療艾滋病。
2,在研臨床階段的CCR5小分子抑製劑。化學小分子抑製劑因其不具有炎症應答效應,且生產成本低等原因,在CCR5抑製劑的研究中占據了主要的地位。十幾年來,在投入了大量的科研成本後,合成了幾十種小分子CCR5抑製劑,其中已進入臨床試驗研究的有下列幾個。

Maraviroc的成功,推動了CCR5抑製劑的研究進展,目前在臨床Ⅱ期試驗中的CCR5抑製劑Cenicriviroc,具有良好抗病毒效果。Cenicriviroc不僅可以結合CCR5,還可以抑製CCR2,使HIV感染者的免疫和代謝等功能增強。
CCR5抑製劑最新研究進展
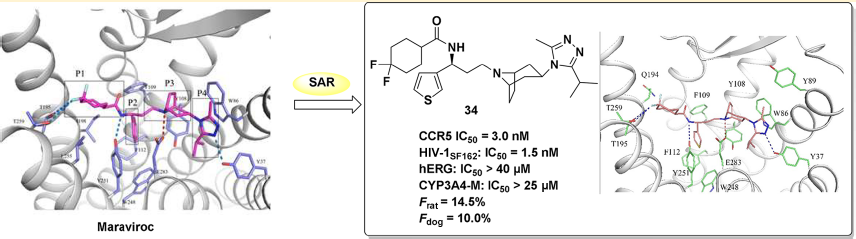
CCR5受體是一個具有較大吸引力的目標,Maraviroc是唯一已上市的CCR5抑製劑。PanfengPeng[2]等人克服maraviroc的缺點,設計、合成並測試了一個新型CCR5抑製劑--小分子化合物34,其能提高抗艾滋病效力和生物利用度。
小分子化合物34是最有活性的CCR5抑製劑,有優良的體外抑製HIV-1的活性,且其細胞毒性低,藥效動力學優秀。因此,化合物34是一種有前景的能夠治療艾滋病毒感染的候選藥物,值得進一步的研究和測試。
參考文獻:
1, Sicoli D, JiaoX, Ju X, et al. CCR5 receptor antagonists block metastasis to bone of v-Srconcogene-transformed metastatic prostate cancer cell lines. Cancer Research.2014, 74 (23): 7103-14.
2, Panfeng Peng,Huan Chen, et al. Structure-Based Design of 1 Heteroaryl-1,3-propanediamineDerivatives as a Novel Series of CC-Chemokine Receptor 5 Antagonists. J. Med.Chem. 2018, 61, 9621-9636.
 相關新聞
相關新聞