近日,hjc黄金城CMC主任周曉堂上海2019藥品研發管理高層論壇培訓班上做了《藥物研發思路》專題演講,下文是演講內容的主要摘要,由hjc黄金城編輯整理,以饗讀者。

hjc黄金城CMC主任 周曉堂
QbD(Quality by Design)的概念最早是在2004年由美國FDA提出的,並被納入到ICH質量體係當中成為指導原則和指南。QbD,即質量源於設計,是指藥物的質量控製應該從最早期的研發設計環節做起。與之前的QbT(Quality by Test), QbP(Quality by Product)相比,進一步向前推進了質量控製包括的環節,為整個過程可以更加充分、科學的研究和開展奠定基礎,使新開發的藥物能夠更加順利的通過檢驗。設計空間(Design Space)是一個與之相伴隨的概念,指的是藥品質量(如溶解度等)與多個生產條件要素參數之間的多維度函數,在此函數中符合藥品質量要求的區域被稱為設計空間,其意義在於之後的研發和生產操作都應在此空間之內,一旦超出則視為變更,需要重新評估調控。(見圖1)

(圖1 設計空間函數曲線)
圖中的橫縱坐標代表了生產條件的兩個重要參數,圖中白色的設計空間即可理解為在設計中符合預期標準的空間。在這個空間內任何條件的組合都被認為是符合預期質量控製的。
設計空間的概念主要在ICH的Q8指導原則中有詳細介紹。Q8、Q9和Q10三個指導原則是ICH在2005年和2008年發布的三個關於質量控製和質量實施工作的指導原則,清晰地解釋了QbD原則及其在整個過程中的各方麵應用。Q8(藥物研發)、Q9(質量風險管理),和Q10(藥物質量係統),是三大貫穿於從處方開發、工藝開發到生產整個藥物生命周期的指導法規,共同發揮作用促進產品的質量係統。其中,Q8(R2)法規中包括了目標產品質量概況(QTPP)和設計空間(DS)的建立和潛在的關鍵質量屬性(CQAs)的確定;Q9法規包括了產品開發過程中的風險評估(QRM),建立控製策略時的風險控製和產品質量持續提升中的風險回顧;Q10主要闡述了藥物質量係統(PQS),包括了工藝性能和產品質量監測係統、CAPA係統、變更管理係統和管理回顧。值得強調的是,三個指導法規是共同,在產品的整個生命周期中發揮作用,將QbD的研發理念付之於實踐的指導原則當中。
那麽引入QbD概念的意義在哪裏呢?從環節上看,它加入了更前端的環節,增加了工作量。然而深入QbD的研發方案所帶來的優勢也是顯而易見的,因為設計對工藝驗證的控製,使得注冊的成本降低;加上對產品持續性的質量控製和係統調控,使得產品上市後變更少,不確定性和風險性降低,整體上降低了失敗的概率。同時,QbD的實驗方案帶來了對工藝更深刻的理解,技術應用和工藝分析的加強,注冊和藥政標準全球化,研發效率提升,最後帶來的是產品質量的全麵提升。所以從全局來看,QbD極大的提高了研發效率,節約了成本,增加了可控性。QbD起始於研發最開始的階段,並貫穿於發展的各個階段和過程,與摸索的階段性結果相結合並提出改進,實現了質量把控的持續更新,螺旋上升。
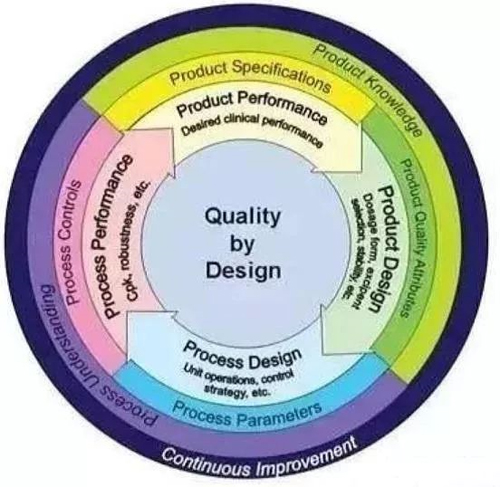
(圖2 QbD的螺旋上升結構)
QbD的理念不是一個步驟,不是前期做好之後就可以一勞永逸的。藥品設計,工藝設計,工藝優化和產品優化四個環節一環扣一環,在研發過程中周而複始不斷循環,螺旋上升,不斷改良。
在應用方麵,QbD理念可以實踐於廣闊的研發和注冊領域。體現QbD理念的Q8、Q9、Q10三大指南對於所有的的產品,產品開發方法和注冊申報均有指導意義,包括但不局限於新藥、仿製藥和已上市的藥品;簡單和複雜劑型;小分子和生物技術產品;傳統研發和QbD研發;ICH管轄的領域及非管轄領域。下麵我們就仿製藥和創新藥為例,來對QbD理念的應用來詳細舉例。
QbD藥物研發在麵對仿製藥和創新藥時有著顯著的差異。仿製藥的研究因為有參比製劑做標準,所以其研發思路和目標都是圍繞參比製劑的。與參比製劑的一致性以及優於參比製劑,是
仿製藥研發的核心目標。仿製藥研發流程主要包括以下幾個模塊:處方前研究,處方工藝研究,工藝放大,工藝驗證和上市申請。仿製藥的處方前研究,包括原輔料性質研究,原輔料相容性研究和參比製劑研究以及反向工程。在仿製藥研究中,常用到的思路是反向工程,即將參比製劑的處方進行拆解和分析,比如用XRPD、NMR等方法對原研藥的API晶型進行解析,通過EMA說明書來分析參比製劑的輔料種類和用料等等,來對參比製劑的原料、處方和製備工藝進行解析,並作為仿製藥研發的標準。
創新藥研發是一個從無到有,摸索前進的過程,因此創新藥的研發具有漸進性和不確定性,主要包括處方前研究,處方工藝研究,臨床前研究,臨床研究I、II&III期研究以及新藥NDA申報。在探索研發的過程中,存在著許多不確定性,在不同的階段下研究目的的側重點也不相同,例如在臨床I期研究階段,著重關注藥物的安全性,而在臨床III期除了研究關鍵批次的安全性外,還要以有效性作為目的來考察。同時由於其不確定性,導致創新藥研發過程中常常會涉及到變更,而在臨床III期時的變更風險相對來說比較大,可能會對藥物的安全性或體內行為產生影響,因此需要進行風險評估並進行適當的橋接研究。
在創新藥摸索的道路上,hjc黄金城生物醫藥是很好的助力,hjc黄金城擁有十幾年參與藥物研發,探索創新藥的經驗,積累了幾十例與國內外大企業共同研發的成功案例,對於QbD的理念有著深刻的認識並認真付諸於實踐和每位科研人員的日常工作中。同時,hjc黄金城生物醫藥在仿製藥的研發上也有著豐富的經驗和嚴謹規範的團隊,為研發和注冊申報的成功保駕護航。

hjc黄金城工藝與放大服務

hjc黄金城製劑服務
hjc黄金城是一家藥物研發外包服務公司(CRO),在上海建立了一家集化合物合成、化合物活性篩選、結構生物學、藥效學評價、藥代動力學評價、毒理學評價、製劑研究和新藥注冊為一體的符合國際標準的綜合技術服務平台,並得到了國際藥品管理部門的認可。hjc黄金城普亞的動物實驗設施獲得AAALAC(國際動物評估與認證協會)認證和中國食品藥品監督管理局GLP證書,並已達到美國食品藥品管理局GLP標準。hjc黄金城以高效、高性價比的一站式專業服務幫助客戶更快地達到目標。
聯係我們:
電話: +86 (21) 5859-1500(總機)



















 相關新聞
相關新聞