
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




2000~2014年,共有301個品種獲得FDA的優先審評資質,其中2014年獲批最多,為37個,而排第二位的年份要追溯到2004年的29個;獲批最少的是2001年,隻有10個。
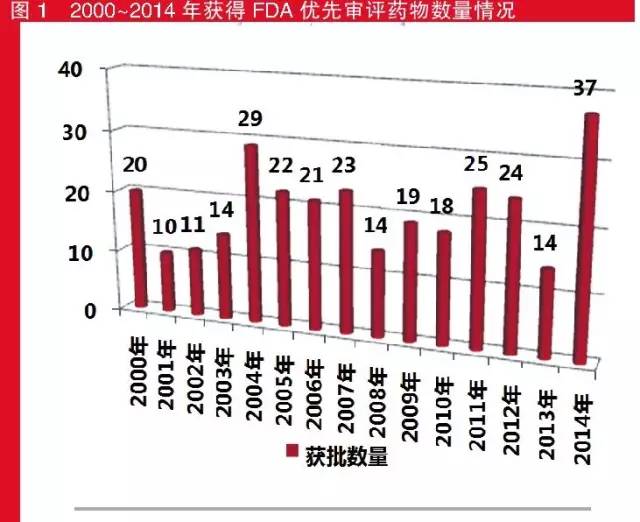
2010-2014年獲得FDA優先審批藥物數量情況
值得注意的是,在2006年至2008年間,由於艾滋病的泛濫,FDA臨時性優先審評批準了20個治療此類疾病的藥物。既獲得優先審評又獲得孤兒藥稱號的“雙獲”藥物則是另一個值得關注的現象。從數量上看,優先審評藥物中新分子實體和獲得孤兒藥稱號數量最多的年份均為2014年,分別為19個和18個;而從占比來看,新分子實體數量占比最高的是2001年,孤兒藥占比最高的是2014年。15年間,有7個年份的NME獲批數量的占比超過了五成,獲孤兒藥稱號的藥物的占比在2014年也接近50%,且近幾年(2013年除外)這種“雙獲”藥物的數量均超過了兩位數。

15年間優先審批藥物中NME及孤兒藥數量占比情況
追蹤近些年來受市場追捧的超級暢銷藥可以發現,雖然有近三成的藥物獲得了優先審評資格,但超級暢銷藥最顯著的特點卻不是優先審批資格,而是它們的身份大多是新分子實體和新生物藥,且大多屬於製藥巨頭。對市場耳熟能詳的超級暢銷藥進行梳理,結果顯示,這其中近九成的藥物為新分子實體和新生物藥;從審評類別看,七成的藥物是通過常規的標準審評獲批的,而剩下的三成優先審評藥物中,新組合藥物等獲批的數量較少。而對於產品的歸屬而言,即使最早的研發企業是小公司,最終產品的擁有者均成為了醫藥巨頭。除此以外,專利導致的市場獨占以及專利到期後產生的斷崖式銷售下跌也為業內熟知。
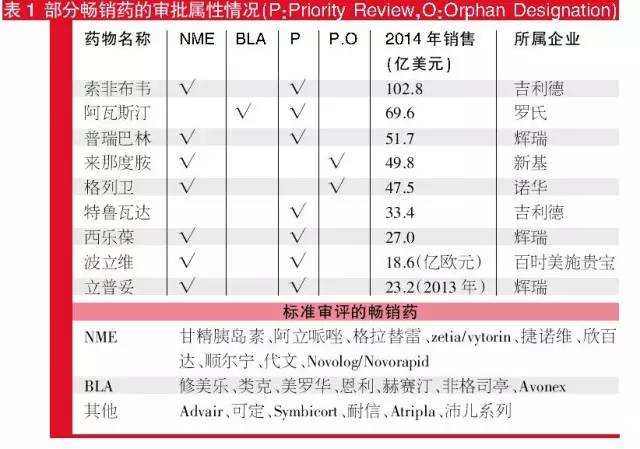
部分長效藥的審批屬性情況
因而可以看出,暢銷藥的成因最重要還是藥物特性、市場規律、企業營銷實力及專利等,優先審評對產品的推動有作用但非主因。 相關新聞
相關新聞