2014年4月美國The Manhattan Institute 發布了一項對美國FDA新藥審批效率評價的研究報告,研究報告稱美國FDA藥物評價與研究中心(Center for Drug Evaluation and Research ,CDER)不同藥物審批部門之間的新藥審評時間存在一定的差異,因此他們認為一些部門比其他部門的工作更“富有成效”。
那麽這項研究結論是否能夠站的住腳?新藥審評時間的差異是否是由工作效率決定的呢?美國FDA的科研人員利用自身的數據進行分析,回答了不同部門之間新藥審評時間差異的根源。
數據和研究方法
FDA的一個重要職責是使患者能夠更快的獲得創新性的新藥。可加快審評提前上市的新藥往往具有以下特點
:1)用來治療一些嚴重或危及生命的疾病;2)填補了未滿足的醫療需求;3)與現有藥物相比,在安全性或有效性方麵得到顯著改善。FDA通過三個手段來縮短創新藥物的審評時間:優先審評、快速通道認定和突破性藥物認定。例如,優先審評規定FDA對新藥上市申請審評時間為6個月,而標準審評的時間為10個月。美國FDA的科研人員利用FDA內部的數據庫,統計了2002年10月至2012年9月30日這段時間內向美國FDA提交的所有小分子新分子實體藥物和生物新分子實體藥物的新藥申請,並計算了新藥的審評時間。
2002-2012年FDA收到並批準250個新分子實體藥物的新藥申請,其中117個藥物為優先審評,87個藥物獲得快速通道認定,1個藥物獲得突破性藥物認定。表1和圖1、圖2為FDA CDER 不同部門收到的新藥上市申請數量以及相應的審評中位時間。研究發現不同部門新藥審評時間長短的差異,是由新藥的一些自身特性決定的。一些部門新藥審評時間之所以短,是因為這些部門接收到更多符合加快審評標準的新藥。
表1 2002-2012年美國FDA CDER不同部門新藥審評時間概況

數據來源:Nat Rev Drug Discov. 2015 Oct;14(10):670-1
優先審評新藥數量對審評時間的影響
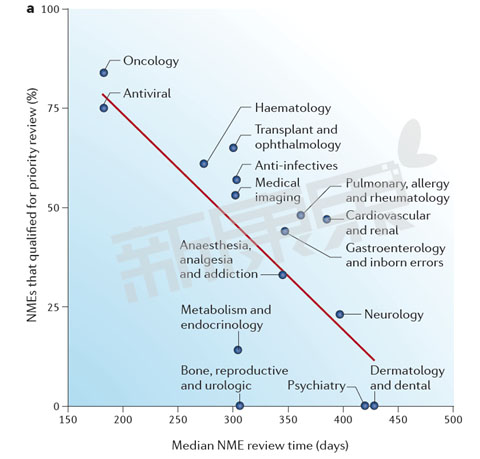
圖1 2002-2012年美國FDA CDER 不同部門優先審評新藥數量和審批時間
數據來源:Nat Rev Drug Discov. 2015 Oct;14(10):670-1
從圖1中我們可以看出FDA CDER 不同部門的審評中位時間與優先審評新藥數量呈很強的負相關性。抗病毒藥(75%)、腫瘤藥物(84%)、血液藥物(61%)優先審評藥物比例最高,FDA審評中位時間最短,抗病毒藥FDA審評中位時間為182天,腫瘤藥物FDA審評中位時間為182天,血液藥物FDA審評中位時間為273天。兩個變量之間的皮爾遜相關係數(Pearson correlation coefficient)為−0.73,這意味著FDA CDER不同部門評審中位時間53%((−0.73) 2 )的差異是由優先評審新藥數量決定的。
快速通道認定新藥數量對審評時間的影響
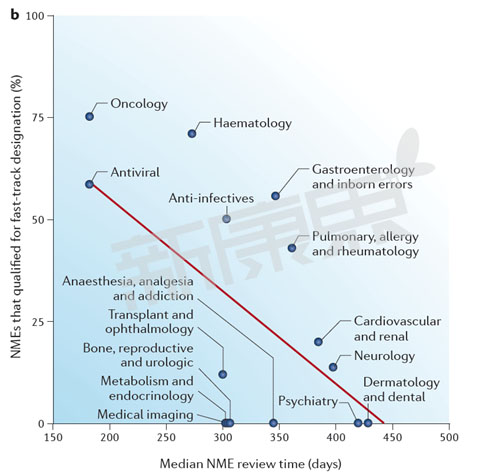
圖2 2002-2012年美國FDA CDER 不同部門快速通道資格認定藥物審批時間概況
數據來源:Nat Rev Drug Discov. 2015 Oct;14(10):670-1
從圖2中我們可以看出FDA CDER 不同部門的審評中位時間與快速通道認定新藥數量呈很強的負相關性。抗病毒藥(58%)、腫瘤藥物(75%)、血液藥物(71%)快速通道認定新藥比例最高,FDA審評中位時間最短,抗病毒藥FDA審批中位時間為182天,腫瘤藥物FDA審批中位時間為182天,血液藥物FDA審批中位時間為273天。兩個變量之間的皮爾遜相關係數(Pearson correlation coefficient)為−0.61,這意味著FDA CDER不同部門審評中位時間37%((−0.73) 2 )的差異是由快速通道資認定新藥數量決定的。
研究結論
FDA數據分析結果表明, 獲得更多優先審評新藥或快速通道認定新藥的部門,如腫瘤藥審批部門和抗病毒藥審批部門,新藥的平均審評時間更短。這點不足為奇,由於新藥自身性質和治療疾病特點的差異,不同新藥審評部門的優先審評新藥和快速通道認定新藥數量存在較大的差異。如與腫瘤相比,皮膚病和牙科疾病很少特別嚴重或危及生命,因此通過快速審評途徑審評的新藥較少,新藥審評時間也長於腫瘤新藥的審評時間。此外,一些疾病領域更有可能在一個特定的時期發生重大的科技突破,因而會隨之產生大量的突破性的新藥,如最近丙型肝炎上市了一係列突破性的新藥。因此,不能把新藥審評時間的長短來作為 FDA CDER 不同部門工作效率高低評價的指標。















 相關新聞
相關新聞