FDA現場檢查和數據完整性要求
FDA對中國企業的檢查
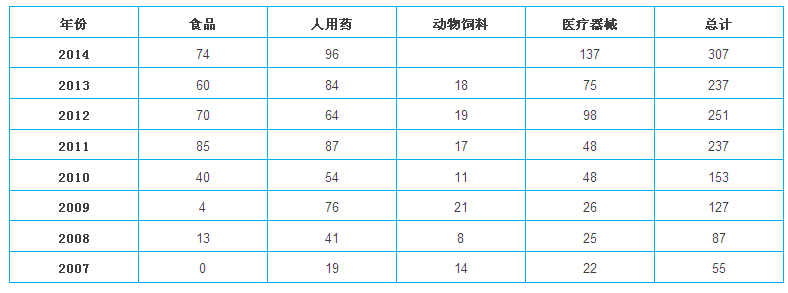
2014年FDA對中國企業檢查次數較多,這並不意味著FDA對中國的檢查數量會無限製增加,但會加大對高風險產品和企業的檢查力度。
FDA在中國的檢查次數
2014年11月,FDA與中國CFDA簽署協議,將FDA中國辦公室常駐美國人員由8個增加到25個,中國的雇員也有所增加,這樣便於在中國能夠進行更多以風險為基礎的、更加及時的檢查。雙方還達成了以下具體的實施計劃:在兩國開展及時、以風險為基礎的檢查,後續跟進檢查視情況而定;在兩國進行檢查前相互預先通知對方;互相觀察在兩國的檢查;及時分享檢查缺陷、違規、召回及不良事件等影響產品安全、質量和公共健康的信息;互相提供在兩國注冊公司的信息。
FDA對數據完整性和電子數據的監管要求
30年前,在美國仿製藥法案剛剛通過後,為爭先申報ANDA(簡略新藥申請),出現了大量的數據造假行為。為此,1991年,FDA開始製訂了一項專門針對申報數據造假的政策,即申請數據完整性指南(AIP),全稱為“欺騙,材料事實的不真實陳述,賄賂和不合法的饋贈;最終政策”。根據此項政策,如果申報材料中數據出現不完整、不一致、不真實的情況,FDA將采取相應措施,直到數據完整真實為止。
在此期間,將禁止其他申請。企業一旦被發現有數據誠信問題,並經調查(包括檢查)核實,就可能被列入AIP的“黑名單”。印度著名的RanbaxyLaboratories公司由於在申報和生產中存在嚴重的數據誠信問題而被FDA列入AIP 的“黑名單”。一旦被列入AIP的“黑名單”,其懲罰是所有關聯申報立即停止審評,所有關聯上市藥品停止銷售,所有未來申報材料拒絕審評,而且所有這些措施都是無限期的。1991年,FDA同樣發布了“內部審評和校正運營計劃方案”。
FDA發布警告信的藥廠原因是在檢查過程中發現企業的數據完整性存在問題,並且在規定要求內無法完成整改。按照美國相關法律法規,數據完整性的重要性體現在,FDA作為監管部門,依賴的是企業申報、生產和檢測過程的資料,由此來判斷企業的產品是否安全有效,質量過關,在此基礎上判斷是否批準企業的產品上市。如果數據完整性出現問題,則所有額度判斷都存在風險,相互信任的基礎也將被打破。
數據完整性是FDA檢查中非常重要的部分,包含真實性、一致性和完整性等方麵。FDA有關法案嚴格要求企業必須有完整的體係,以保證計算機數據的完整性和原始性,具體到資料記錄、拷貝、打印等細節,還要求所有的測驗數據不能具有選擇性的,更不能有選擇性的刪除或者不報告,否則需要注明原因,這些數據需要隨時準備妥當以備檢查需要。FDA還強調所有的設備必須有審計追蹤係統,並且需要通過檢查確定企業數據完整性是否存在問題。
數據完整性是一個持續的問題,貫穿到從申報到生產的全過程,實際上,真正重點在於申報期間材料的完整性,那是更大風險控製的關鍵。數據完整性問題,無論是中國還是國際上,包括美國很多企業同樣存在,隻是問題大小和多少有所不同,通常數據完整性出問題,不是某個QC員工的問題,更糟糕的可能是企業問題和來自上層壓力的體係問題。
在中國企業檢查過程中問題,中國企業很多實驗和生產設備沒有審計追蹤係統,數據無法保留而出現不完整。還缺乏原始數據支撐所形成的記錄,所報告微生物數據與所見情況不一致,最常見、最容易犯錯的問題是記錄不及時,或者為了驗證而人為延遲記錄時間,更嚴重的是直接人為造假,比如計算機權限管理不規範造假,如果在檢查中,發現對原始數據進行改變的,FDA會要求企業重新檢測。對於企業來說,要考慮為什麽出現這些問題?有哪些風險信號顯示可能存在風險,比如人工記錄數據。需要強調,不能以某個標準作為目標,可能會導致工作人員在實際試驗、生產或檢查中存在壓力,而出現人為的錯誤,比如不報告問題、修改數據等,一個負責任的企業應鼓勵並協助員工報告真實情況。
FDA強烈建議企業邀請第三方機構進行審計、檢查及解決問題,FDA不太相信企業自身能夠合規地完成這些要求,FDA會對整個企業所有的計算機體係和產品進行全麵評估,以便確定產品的風險程度。

分享到:















 相關新聞
相關新聞