9月共總結了33個批準,其中FDA批準14個(包含2個化藥仿製藥批準、1個生物類似物批準以及1個新分子實體獲得批準),EMA批準4個,以及日本批準15個(2個新分子實體)。(由於公司官網更新的更及時,本文中時間來自各公司官網,可能與FDA、EMA以及PMDA上的時間有差異)
本月最震撼的兩個批準一個是新分子實體的批準,即Sarepta Therapeutics的Eteplirsen治療杜氏肌營養不良(DMD)。大家對此藥褒貶不一,Eteplirsen帶來的意義目前不好評論,但是作為第一個獲批的DMD藥物,無論以什麽形式落幕,都是一個DMD裏程碑事件。另一個是Amgen的藥王修美樂生物類似藥獲得批準,它是美國FDA批準的第4個生物類似藥。
日本方麵,其中兩個批準非常有意思,而且這兩個批準是兩個新分子,都是第一次批準,但是兩個分子一組合就成了Zepatier,Zepatier已於2016年1月28日獲得美國FDA批準,用於有或沒有ribavirin (利巴韋林)治療慢性丙型肝炎病毒(HCV)感染的基因1和基因4型成人患者,並且有一批藥在日本都是第一次批準。
(一) FDA 9月批準匯總
1日,FDA批準Medicure的抗凝藥Aggrastat(鹽酸替羅非班)15ml。該藥將於下個季度上市。導管插入護士及介入心髒外科醫生都表示他們更希望使用單瓶的藥物而不是目前的靜脈輸液劑型。
2日,印度希普拉公司(CIPLA)宣布其Enablex®仿製藥達非那新緩釋片(7.5 mg,15 mg)獲美國FDA批準上市,用於治療尿失禁、尿急和尿頻等膀胱活動過度症(OAB)。IMS 數據顯示,截止6月底該藥美國年銷售額為8500萬美元。
2日,印度瑞迪博士(Dr. Reddy’s)宣布在美國上市其仿製藥鹽酸安非他酮緩釋片(100 mg, 150 mg和200 mg)。IMS 數據顯示,截止7月底該藥美國年銷售額為1.09億美元。
14日,Shire宣布其免疫球蛋白產品Cuvitru (免疫球蛋白[人]皮下注射液,20%)獲得美國FDA批準,用於2歲及以上兒童及成人原發性免疫缺陷症 (Primary Immunodeficiency,PI)的治療。Cuvitru是唯一一種濃度高達20%(高濃度)的皮下注射免疫球蛋白產品。與常規的低濃度皮下注射免疫球蛋白產品相比,其注射位點更少,輸注持續時間更短。
15日,Aralez 宣布美國FDA批準每日一次的緩釋片Yosprala™用於心血管病和腦血管的二級預防,適應人群為阿司匹林伴隨的相關潰瘍患者。Yosprala™是一款複方藥,由抗血小板藥Aspirin(阿司匹林)和質子泵抑製劑(PPI) Omeprazole(奧美拉唑)固定劑量組合。
19日,美國FDA批準了Sarepta Therapeutics公司的新藥 Exondys 51 (eteplirsen)注射液,用於治療杜氏肌營養不良症(DMD)患者,這也是首個經FDA批準用於治療該疾病的新藥。
19日,Bayer的新型IUD產品Kyleena獲得FDA批準用於避孕,時間長達5年。該IUD包含19.5mg的左炔諾孕酮,將在下個月開始上市。Kyleena (levonorgestrel,左炔諾孕酮宮內緩釋係統)是一種低劑量孕酮宮內緩釋係統,其避孕效果可以達到5年。
20日,KVK-Tech宣布美國FDA批準Lomaira (phentermine hydrochloride USP,鹽酸苯丁胺) 用於短期成人體重的減輕,且至少有一項關於體重相關的指征,如高血壓、糖尿病以及高膽固醇等。Lomaira是一種擬交感胺類減食欲劑,是一種低成本、低劑量的處方藥。
21日,Janssen的InvokametXR(卡格列淨和二甲雙胍緩釋複方)獲得美國FDA批準,用於與飲食和鍛煉相結合,作為2型糖尿病的一線治療。該藥物有4種劑量,每天一次。
23日,Amgen宣布FDA批準全球最暢銷藥物Humira的生物類似藥Amjevita™ (Adalimumab-Atto)用於RA、銀屑病關節炎、克羅恩病、銀屑病等7種炎症。該藥是FDA批準的第4個生物類似藥。上個月FDA剛剛批準了Novartis的Amgen公司Enbrel生物類似藥。
23日,Novartis宣布美國FDA擴大批準Ilaris® (canakinumab),連續批三個適應症, Ilaris 是第一個,也是唯一一個獲得FDA批準治療的腫瘤壞死因子受體相關定期綜合征(TRAPS),高免疫球蛋白D綜合征(HIDS) / 甲羥戊酸激酶缺乏症(MKD)和家族性地中海熱(FMF)。
23日,FDA批準Silvergate Pharmaceuticals的Epaned口服製劑(馬來酸依那普利)用於1個月以上嬰兒以及成人的高血壓患者。該藥為口服溶劑,1mg/mL,150ml,混合漿果味。
23日,楊森宣布 Stelara® (ustekinumab)的新適應獲得美國FDA批準,用於治療節段性回腸炎,克羅恩氏病。
28日,Vertex的Orkambi (lumacaftor/ivacaftor)獲得FDA批準擴大適應症使用範圍,用於6-11歲帶有2個F508del突變的囊性纖維化患者。該藥之前已經獲得批準用於12歲及以上該適應症患者。
(二) EMA 9月批準匯總
6日,Bristol-Myers Squibb宣布歐盟批準Orencia® (abatacept)治療未經甲氨蝶呤的類風濕性關節炎。Abatacept是一種選擇性T細胞共刺激調節器,能與T細胞上的CD80和CD86結合,阻斷其與CD28的相互作用,從而抑製T細胞活化。最早獲批於2005年。
14日, Exelixis以及Ipsen分別宣布其口服抗癌藥Cabometyx (cabozantinib)獲歐盟批準,用於前一次治療為血管內皮生長因子(VEGF)靶向療法治療失敗的晚期腎細胞癌。該藥已於今年 4 月獲美國 FDA 批準治療晚期腎細胞癌。該藥最早獲批於2012年用於甲狀腺髓樣癌的治療。
15日,衛材(Eisai)宣布其新型抗癌藥Kisplyx (lenvatinib,樂伐替尼)獲歐盟批準用於治療晚期或轉移性腎細胞癌,且患者至少接受一種VEGF治療。此前已獲歐盟授予快速審評資格。在美國,該藥已獲美國FDA授予突破性療法資格,並於今年5月此適應症獲批。
23日,艾爾健(Allergan)免疫管線宣布,歐盟委員會(EC)已批準該公司藥物Truberzi (eluxadoline)用於腹瀉型腸易激綜合征(IBS-D)患者的治療。此次批準,使Truberzi成為歐洲IBS-D群體中首個治療藥物。艾爾健表示,將在2017年將產品推向歐洲市場。
(三)日本 9月批準匯總
28日,日本批準Humira (修美樂,Adalimumab)的又一適應症,用於中後全葡萄膜炎。
28日,武田宣布,日本衛生勞動福利部(MHLW)已批準糖尿病複方新藥Inisync複方片,用於2型糖尿病的治療。Inisync複方片由固定劑量的Nesina (alogliptin,阿格列汀,25mg)和二甲雙胍(500mg)組成,每日口服一次。此次批準,使Inisync成為日本市場唯一一種每日口服一次的DPP-4和二甲雙胍複方藥。
28日, Otsuka製藥公司收到了日本批準Iclusig (ponatinib)治療對之前療法耐藥或不耐受的慢性粒細胞白血病以及複發或難治性費城染色體陽性急性淋巴細胞性白血病的通知。
28日, Otsuka製藥宣布,該公司開發的抗精神病藥物Abilify (aripiprazole,阿立呱唑)獲日本監管批準,用於治療兒童自閉症譜係障礙相關的煩躁易怒症狀。此次批準,也是Abilify獲批的第4個適應症。之前,Abilify已獲批治療:1)精神分裂症;2)I型雙相情感障礙相關的躁狂或混合性發作;3)抗抑鬱療法治療不佳的重度抑鬱症的輔助治療。
28日,AstraZeneca宣布Brilique® (Ticagrelor,替格瑞洛)獲得日本醫藥品醫療器械綜合機構批準上市。替格瑞洛是P2Y12血小板抑製劑,用於成人急性冠脈綜合征(如不穩定型心絞痛、非ST段抬高心肌梗死【NSTEMI】或ST段抬高心肌梗死【STEMI】)患者,包括曾接受過藥物治療、經皮冠狀動脈介入(PCI)治療及冠狀動脈旁路移植術(CABG)的患者。
28日,Aegerion宣布Juxtapid® (Lomitapide Mesylate,甲磺酸洛美他派)用於治療純合子家族性高膽固醇血症獲得PMDA的批準。該藥於2012年12月21日獲美國FDA首批,之後於2013年7月31日獲得EMA批準。甲磺酸洛美他派是一種微粒體甘油三酯轉移蛋白抑製劑(MTP,MTTP),作為低脂肪飲食及其他降脂藥的輔助藥物。
28日,Astellas(安斯泰來)宣布Kiklin®顆粒劑用於慢性腎病高磷血症的治療收到日本的批準。該藥的膠囊劑型早在2012年就獲批用於慢性腎病透析患者的高磷血症,直到今年2月底,才將範圍擴大到非透析患者。
28日,安斯泰來和Nippon Boehringer Ingelheim宣布複方藥Micatrio®獲得日本批準。Micatrio®由血管緊張素II受體拮抗劑(ARB)Telmisartan(替咪沙坦)、長效鈣通道阻滯劑(CCB) amlodipine besylate(苯磺酸氨氯地平)以及噻嗪類利尿劑hydrochlorothiazide(氫氯噻嗪)組成。
28日,默沙東的Elbasvir獲日本批準上市,商品名為Erelsa®。Elbasvir是HCV NS5A的抑製劑,用於治療基因1型慢性丙型肝炎病毒(HCV)感染或者改善C型代償性肝硬化導致的病毒血症的病症。雖然該藥的聯合用藥早已批準,但此次,是Elbasvir的首次批準。
28日,默沙東的Grazoprevir獲日本批準上市,商品名為Grazyna®。Grazoprevir是HCV NS3/4A蛋白酶抑製劑,用於治療基因1型慢性丙型肝炎病毒(HCV)感染或者改善C型代償性肝硬化導致的病毒血症的病症。該藥與上一個藥聯合使用早已獲批,但此次也是Grazoprevir的首次批準。
28日,默沙東的Keytruda® (Pembrolizumab)治療黑色素瘤獲得日本批準,有意思的是這個藥在歐盟和美國都獲得多個批準了,但在日本Keytruda是第一次獲批。
28日,默克雪蘭諾的Ovidrel/Ovitrelle (Choriogonadotropin alfa,絨促性素α)治療不孕症獲得日本批準。絨促性素α是一種重組的人絨毛膜促性腺激素,能促進卵泡成熟、恢複減數分裂,並啟動排卵前卵泡破裂。該藥用於治療女性不排卵造成的不育症,但不適用於原發性卵巢功能衰竭。在日本絨促性素α是第一次獲批。
28日,百時美施貴寶的Empliciti (Elotuzumab)治療多發性骨髓瘤獲得日本批準。Elotuzumab是一種免疫刺激性單抗,可特異性結合信號淋巴細胞活化分子家族成員7 (SLAMF7),並激活機體免疫應答,以攻擊並殺滅多發性骨髓瘤細胞。Elotuzumab由百時美施貴寶和艾伯維(Abbvie)共同開發。在日本Elotuzumab是第一次獲批。
28日,勃林格殷格翰的Praxbind®和Prizbind® (Idarucizumab)治療緊急手術、出血獲得日本批準。Idarucizumab是一種達比加群特異性逆轉劑,能與達比加群結合並中和其抗凝血作用。該藥批準用於使用達比加群進行治療的患者的緊急手術和危及生命或不受控製的出血。在日本Idarucizumab是第一次獲批。
28日,CSL Behring宣布凝血因子IX (重組)融合白蛋白Idelvion (Albutrepenonacog Alfa)治療B型血友病獲得日本批準,Idelvion能被應用於所有年齡段的治療,Idelvion的批準,為患有B型血友病的兒童和成人提供了另外一個重要的治療選擇,從而來阻止或控製出血,減少出血的頻率。在日本Albutrepenonacog Alfa是第一次獲批。
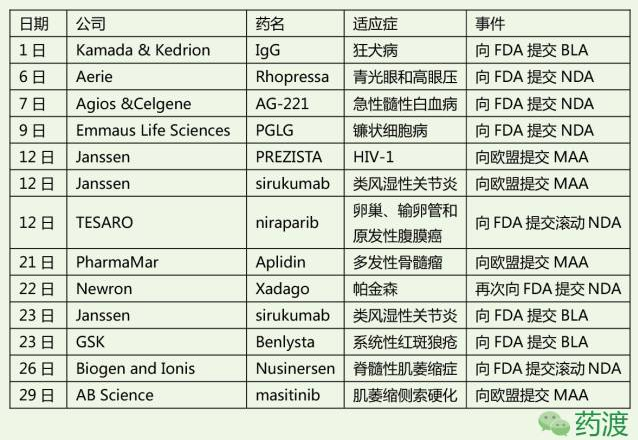
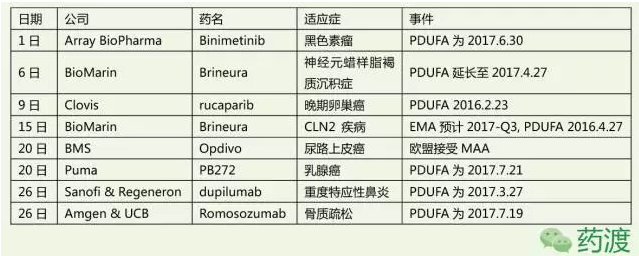
另外,以下是本月的NDA、BLA提交申請、以及接受申請匯總情況。
















 相關新聞
相關新聞