
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




2015年12月份美國FDA共審批通過13種新藥,1類新分子實體藥物4個; 新生物藥物1個;3類新劑型藥物2個;5類新規格或新生產商藥物5個;10類新藥1個。
表1 2015年12月份美國FDA審批通過新藥
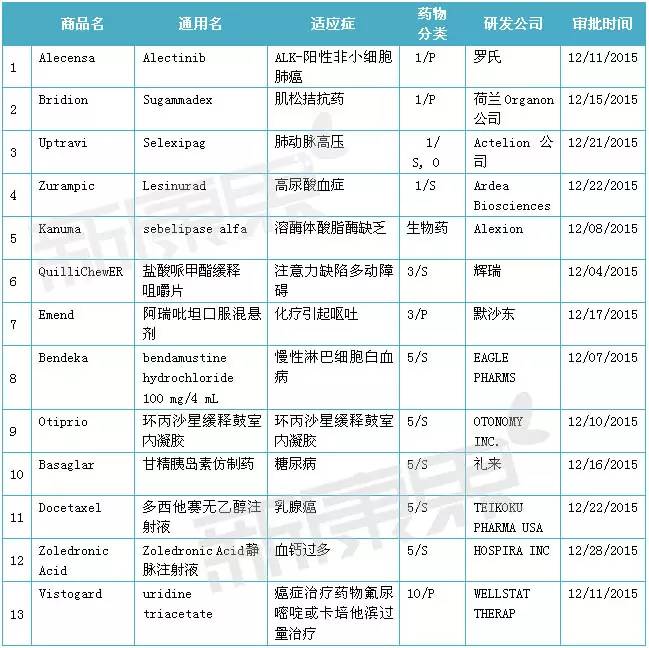
注:1)化學新藥分類:1類新分子實體化合物;3類新劑型;5類藥物新規格或新生產商; 10類適應症不同的新的新藥申請。審批分類:P優先評審;S常規評審
2015年12月11日,美國FDA通過優先審批途徑批準羅氏公司研發的新分子實體藥物Alectinib(Nucala)上市,用於克唑蒂尼(Crizotinib)治療後發生進展的ALK (間變性淋巴瘤激酶) 陽性惡性非小細胞肺癌患者的治療。Alectinib為一種靶向ALK和RET的激酶抑製劑,可抑製ALK的磷酸化和ALK介導激活的下遊信號通路基因STAT3和AKT的活性。Alectinib為膠囊劑,規格為150mg,患者每日服用兩次每次600mg,需要注意的是Alectinib需要與食物同服。
2015年12月15日,美國FDA通過優先審批途徑批準荷蘭Organon公司研發的新分子實體藥物Sugammadex(Bridion)上市,用於快速逆轉成年患者手術中麻醉劑羅庫溴銨(rocuronium bromide)和維庫溴銨(vecuronium bromide)引起的神經肌肉阻斷。Sugammadex是一種人工合成的改良γ-環糊精,由親脂核心和親水外端組成。Sugammadex經由靜脈注射給藥,在使用過程中需密切關注患者的狀況。Sugammadex可以顯著改善手術後肌鬆的恢複,短時間內迅速逆轉甾體類肌鬆藥的神經肌肉阻滯作用對於提高全身麻醉的安全性具有積極的意義。
2015年12月21日,美國FDA批準Actelion公司研發的新分子實體藥物Selexipag(Uptravi)上市,用於成人肺動脈高壓患者的治療。Selexipag(Uptravi)被美國FDA認定為孤兒藥。肺動脈高壓是一種慢性進行性肺部疾病,預後不佳,患者可能過早死亡或需要肺移植。Selexipag是一種口服的Ip前列腺環素受體激動劑,可鬆弛血管壁平滑肌,擴張血管,降低肺動脈壓力。
2015年12月22日,美國FDA批準Ardea Biosciences 公司研發的高尿酸血症新藥Lesinurad(Zurampic)上市,與黃嘌呤氧化酶抑製劑(XOI)聯用治療痛風相關性血尿酸水平過高(高尿酸血症)患者的治療。Lesinurad URAT1 抑製劑,作用機製是幫助腎髒排泄尿酸,通過抑製腎髒中參與尿酸重吸收的轉運蛋白功能來發揮作用。Zurampic帶有黑框警告,使用特別是單獨使用Zurampic時患者有發生急性腎功能衰竭的風險,為醫療保健專業人員提供了重要安全信息。
2015年12月08日,美國FDA批準Alexion 公司研發的新生物藥物Kanuma(sebelipase alfa)上市,在所有年齡的溶酶體酸脂酶缺乏(LAL-D)患者中用於長期的酶替代治療(ERT)。LAL-D 是一種遺傳性、慢性及進展性的代謝疾病,是一種罕見病,患有該病的嬰兒、兒童及成年人會遭受多種器官的損傷及過早死亡。
美國FDA審批新藥主要是根據藥物化學類型和治療潛能來進行分類的。新藥按化學類型主要分為:1類新分子實體化合物(NME),創新性最強。指在美國從未作為藥品批準或銷售的活性成分,可以是單一成分,也可以是立體異構混合物中的一部分;2類新的衍生物。從已上市的活性成分(即所謂“專利”藥)化學衍生而來,即已在美國上市的活性成分的酯、鹽或其它非共價鍵衍生物,或者是去修飾基團的母體化合物未在美國批準上市的;3類新劑型。含有已上市活性成分的新劑型或新處方,其適應症可以與上市產品相同,也可以不同;4類新組合物。含有兩種或兩種以上已上市的活性成分的品種,上市產品中尚無這種組合;5類藥物新規格或新生產商;6類新適應症。由同一家公司或其他公司在美國批準或上市的具有新用途的複製品;7類已上市但未經NDA批準的藥品。適應症已與上市產品相同,也可不同;8類變為非處方藥;9類(New indication submitted as distinct NDA - consolidated with original NDA after approval); 10類適應症不同的新的新藥申請。
 相關新聞
相關新聞