7月21日,CDE發布《擬納入優先審評程序藥品注冊申請的公示》,所涉及的6個產品分別為:拜耳的瑞戈非尼片(受理號:JXHS1500103)、諾華的磷酸蘆可替尼片(受理號:JXHS1500114)、輝瑞的枸櫞酸托法替布片(受理號:JXHS1500126)、勃林格殷格翰的尼達尼布軟膠囊(受理號:JXHL1500078)、新基的注射用阿紮胞苷(受理號:JXHS1400125)和羅氏的維莫非尼片(受理號:JXHS1600039)。除尼達尼布軟膠囊外,其餘5個藥物均為申報生產。
在上述擬納入優先審評程序藥品注冊申請的6個藥物中,有4個為抗腫瘤藥物(瑞戈非尼片、磷酸蘆可替尼片、注射用阿紮胞苷和維莫非尼片),1個呼吸係統用藥(尼達尼布軟膠囊),1個肌肉-骨骼用藥(枸櫞酸托法替布片)。值得一提的是,注射用阿紮胞苷屬2015年7月22日公布的1622個自查核查目錄產品,而瑞戈非尼片、磷酸蘆可替尼片和枸櫞酸托法替布片則屬第2批自查核查目錄產品。

瑞戈非尼由拜耳和Onyx聯合開發,於2012年9月27日獲美國FDA批準以商品名Stivarga上市,規格為40mg。臨床上用於治療既往使用過氟尿嘧啶、奧沙利鉑和伊立替康為基礎化療的轉移性結直腸癌(CRC)。2013年2月,FDA又批準其用於治療先前接受過伊馬替尼和舒尼替尼治療的局部晚期、不能手術切除或轉移性胃腸道間質瘤(GIST)。
我國擬納入拜耳醫藥保健有限公司的瑞戈非尼片優先審評程序的適應症為晚期轉移性CRC。據統計,2011年我國CRC的發病率和死亡率分別為23.03/萬和11.11/10萬,且呈逐年增長趨勢。我國目前用於治療晚期或轉移性CRC的藥物主要有5-FU/LV、伊立替康、奧沙利鉑、卡培他濱、西妥昔單抗和貝伐珠單抗等。瑞戈非尼片在我國的上市有望對那些使用過氟尿嘧啶、奧沙利鉑和伊立替康治療後疾病進展的CRC提供一種新的可行的治療方案。
膦酸蘆可替尼由美國Incyte開發,於2011年11月16日獲美國FDA批準以商品名Jakafi上市,上市規格有5mg、10mg、15mg、20mg和25mg。Jakafi是美國FDA批準的首個用於治療原發性骨髓纖維化(PMF)的藥物。
磷酸蘆可替尼是一種非受體型酪氨酸激酶JAK1/2抑製劑,其通過阻斷JAK1/2信號轉導及轉錄激活因子通過而發揮作用。臨床研究結果顯示,PMF患者經使用本品治療32個月後,總生存率達69%。同時,PMF患者使用本品長期治療後,腫大的脾髒縮小,且可減輕與PMF相關的臨床症狀。本品常見不良反應是血小板減少、貧血、乏力、腹瀉、呼吸困難、頭痛、頭暈和惡心等。
我國擬納入北京諾華製藥有限公司的磷酸蘆可替尼片優先審評程序,適應症為PMF。美國將PMF定義為一種罕見病。PMF的年發病率為0.6-1.3/10萬,美國發病率為1.5/10萬。我國目前尚無詳實的流行病學數據。基於我國人口基數較大,且隨著環境惡化以及人口老齡化,預計我國PMF患者並不少見。PMF的中位生存期為3.5-5.5年,約有10%~15%的患者最終將轉化為急性白血病。
我國目前主要針對PMF患者出現的如貧血、脾腫大、體質性症狀、症狀性髓外造血等臨床症狀進行常規治療。英國骨髓纖維化研究和診治指南(2014)推薦PMF患者在以下情況首選蘆可替尼治療:症狀性脾髒腫大,影響生活質量的PMF相關症狀,PMF導致的肝髒腫大和門脈高壓。可見,蘆可替尼臨床地位漸已凸顯。
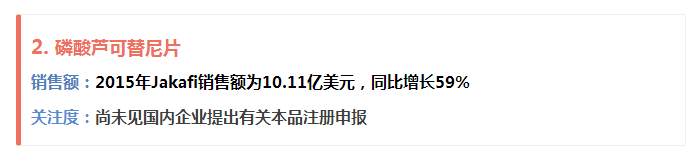
在美國獲準上市後不到5年的Jakafi如今已成為名副其實的重磅炸彈級藥物。來自EvaluatePharma的數據顯示,2015年Jakafi銷售額為10.11億美元,同比增長59%。若磷酸蘆可替尼片在中國順利獲準上市將有望解決國內PMF患者無藥可用的局麵,為PMF患者提供一種新的治療方案,預計可產生較大的社會效益。目前,尚未見國內企業向CFDA提出有關磷酸蘆可替尼片的注冊申報。
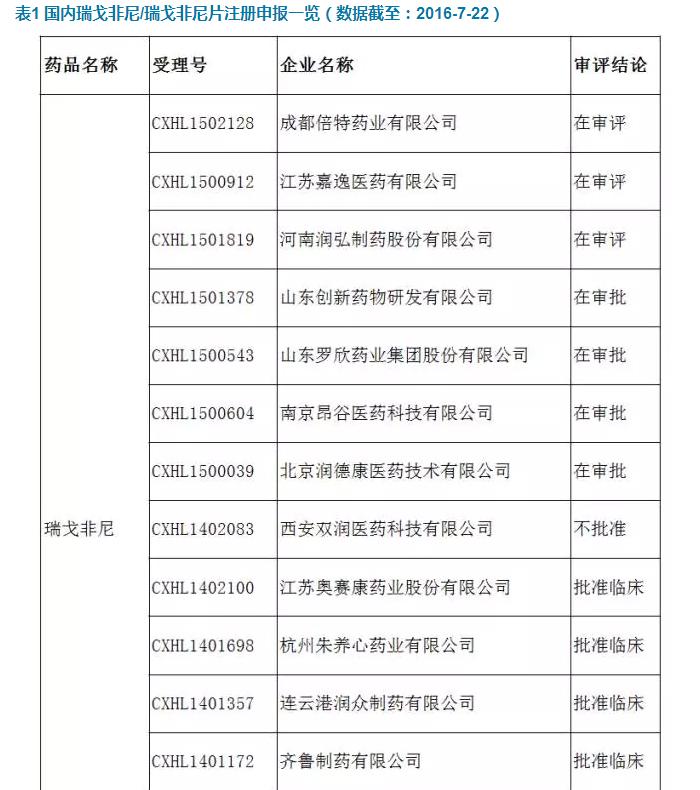
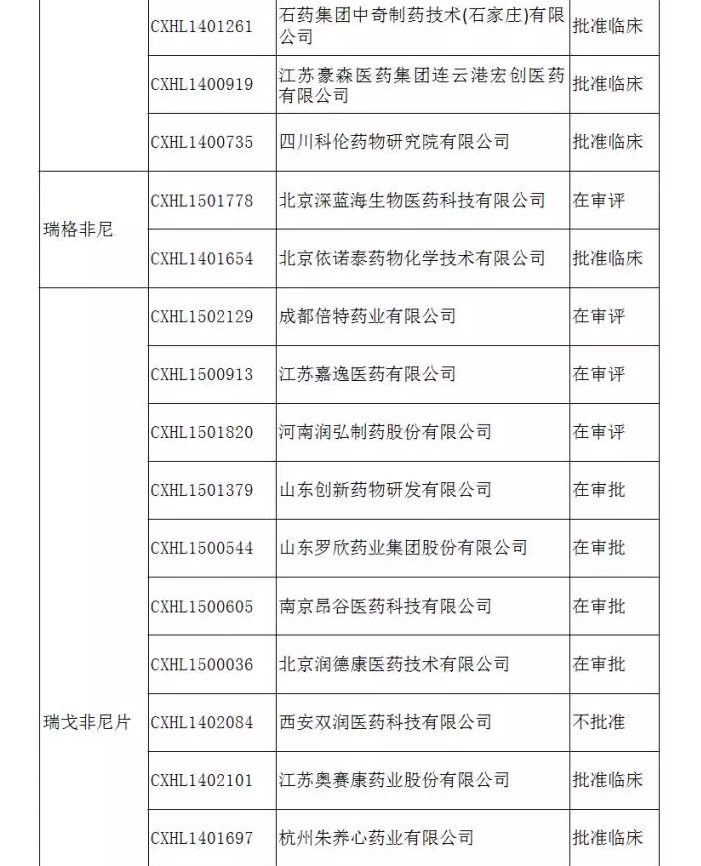
來自EvaluatePharma的數據顯示,2015年Stivarga的銷售額為3.47億美元,同比增長17%。據悉,除原研公司已向CFDA提出有關瑞戈非尼的進口注冊申請外,國內已有多家企業按照3.1類新藥提出注冊申請,其中,江蘇豪森、江蘇奧賽康和四川科倫等企業已獲臨床批文(詳見表1)。由此預計:未來幾年,在為我國轉移性CRC患者提供一種新的治療方案的同時,瑞戈非尼國內市場競爭將會相當激烈。

膦酸蘆可替尼由美國Incyte開發,於2011年11月16日獲美國FDA批準以商品名Jakafi上市,上市規格有5mg、10mg、15mg、20mg和25mg。Jakafi是美國FDA批準的首個用於治療原發性骨髓纖維化(PMF)的藥物。
磷酸蘆可替尼是一種非受體型酪氨酸激酶JAK1/2抑製劑,其通過阻斷JAK1/2信號轉導及轉錄激活因子通過而發揮作用。臨床研究結果顯示,PMF患者經使用本品治療32個月後,總生存率達69%。同時,PMF患者使用本品長期治療後,腫大的脾髒縮小,且可減輕與PMF相關的臨床症狀。本品常見不良反應是血小板減少、貧血、乏力、腹瀉、呼吸困難、頭痛、頭暈和惡心等。
我國擬納入北京諾華製藥有限公司的磷酸蘆可替尼片優先審評程序,適應症為PMF。美國將PMF定義為一種罕見病。PMF的年發病率為0.6-1.3/10萬,美國發病率為1.5/10萬。我國目前尚無詳實的流行病學數據。基於我國人口基數較大,且隨著環境惡化以及人口老齡化,預計我國PMF患者並不少見。PMF的中位生存期為3.5-5.5年,約有10%~15%的患者最終將轉化為急性白血病。
我國目前主要針對PMF患者出現的如貧血、脾腫大、體質性症狀、症狀性髓外造血等臨床症狀進行常規治療。英國骨髓纖維化研究和診治指南(2014)推薦PMF患者在以下情況首選蘆可替尼治療:症狀性脾髒腫大,影響生活質量的PMF相關症狀,PMF導致的肝髒腫大和門脈高壓。可見,蘆可替尼臨床地位漸已凸顯。
在美國獲準上市後不到5年的Jakafi如今已成為名副其實的重磅炸彈級藥物。來自EvaluatePharma的數據顯示,2015年Jakafi銷售額為10.11億美元,同比增長59%。若磷酸蘆可替尼片在中國順利獲準上市將有望解決國內PMF患者無藥可用的局麵,為PMF患者提供一種新的治療方案,預計可產生較大的社會效益。目前,尚未見國內企業向CFDA提出有關磷酸蘆可替尼片的注冊申報。

於2012年11月6日獲美國FDA批準上市的枸櫞酸托法替布片(商品名:Xeljanz)是由輝瑞開發的一種治療類風濕關節炎(RA)的首創藥物。
枸櫞酸托法替布是一種JAK3激酶抑製劑,其對JAK3的抑製強度是JAK1、JAK2的5~100倍。枸櫞酸托法替布片適用於對甲氨喋呤反應不佳或不能耐受的中至重度活動性RA成年患者;可用作單藥或與甲氨喋呤或其他非生物製品疾病修飾抗風濕藥物(DMARDs)聯用治療RA。此外,美國FDA還於2016年2月23日批準輝瑞的枸櫞酸托法替布緩釋片(商品名:Xeljanz)。其中,速釋片的規格為5mg,緩釋片的規格為11mg。
臨床試驗證實,枸櫞酸托法替布片可改善RA的臨床症狀和體征,減緩關節結構損傷,改善機體功能,其主要不良反應包括頭痛、頭暈、惡心、嘔吐、鼻咽炎、呼吸道感染等。枸櫞酸托法替布的問世對治療RA具有劃時代的裏程碑意義。
RA是一種以慢性侵蝕性關節炎為特征的全身性自身免疫性疾病,若不經正規治療,約有75%的患者將在3年內出現殘疾。據統計,我國RA總患者人數已超過500萬。GlobalData曾預計未來10年(2013-2023)全球RA市場將以2.1%的年複合增長率增長,到2023年將達193億美元。另有行業專家分析認為,2022年前驅動RA市場增長的主要驅動力為JAK抑製劑。來自EvaluatePharma的數據顯示,2015年枸櫞酸托法替布片銷售額為5.23億美元,同比增長70%。
據悉,國內已有包括重慶醫工院、四川海思科、齊魯製藥、山東羅欣、浙江海正和四川科倫等在內的30多家企業按照3.1類新藥向CFDA提出枸櫞酸托法替布片注冊申請,而且至少20家企業已獲臨床批文。可見,枸櫞酸托法替布片未來國內市場競爭將異常激烈,其市場格局究竟如何值得期待。

於2014年10月15日獲美國FDA批準的尼達尼布軟膠囊(商品名:Ofev)是由德國勃林格殷格翰開發的一種用於治療特發性肺纖維化(IPF)的藥物,上市規格有100mg 和150mg。在歐洲,2014年10月,EMEA批準尼達尼布與多西紫杉醇合並用於一線化療後局部晚期、轉移性或局部複發性非小細胞肺癌成人患者,商品名為“Vargatef”。同年12月,歐洲EMEA還批準尼達尼布用於治療IPF。
尼達尼布是一種三聯血管激酶抑製劑,其作用靶點有血小板源生長因子(PDGF)、血管內皮生長因子(VEGF)和堿性纖維母細胞生長因子(bFGF)。尼達尼布與上述各受體的ATP結合位點競爭性結合,阻斷IPF病理機製中至關重要的成纖維細胞增殖、遷移和轉化的細胞內信號。
除尼達尼布外,美國FDA還批準了另一款可用於治療IPF的藥物為吡非尼酮(商品名:Esbriet)。來自EvaluatePharma的數據顯示,2015年Ofev的銷售額為3.33億美元,而Esbriet則為5.85億美元。
吡非尼酮目前已實現國產化。盡管吡非尼酮的問世已解決我國IPF患者的用藥可及性問題,但尼達尼布的上市有望為我國IPE患者提供新的治療方案。據悉,國內目前已有包括正大天晴、四川科倫和江蘇豪森等多家企業向CFDA提出有關本品的注冊申請。

於2004年5月19日獲美國FDA批準的注射用阿紮胞苷(商品名:Vidaza)是首個獲批用於治療骨髓發育不良綜合征(MDS)的藥物,規格為100mg/瓶。Vidaza適用於難治性貧血(RA)、環形鐵粒幼細胞性難治性貧血(RARS)、難治性貧血伴原始細胞增多(RAEB)、難治性貧血伴原始細胞增多轉變型(RAEB-T)和慢性粒-單核細胞白血病(CMMoL)。
阿紮胞苷是一種胞嘧啶核苷衍生物,參與DNA複製,通過對DNMT阻斷甲基化反應的中間過程進行抑製,從而抑製細胞的基因組DNA的甲基化狀態。阿紮胞苷的作用呈劑量依賴性:低濃度時通過降低細胞內的DNMT可使基因甲基化程度降低;高濃度時參與DNA的複製或RNA的翻譯,從而產生細胞毒性作用。
阿紮胞苷的主要競爭者是地西他濱,但有臨床研究數據顯示地西他濱不能提高MDS患者的生存率。值得一提的是,2011年美國國立綜合癌症網絡(NCCN)指南將阿紮胞苷作為中危-2及高危MDS治療的首選藥物。可見,阿紮胞苷治療MDS的臨床地位意義深遠。期待阿紮胞苷盡快在國內上市,以解決我國目前MDS治療不能滿足臨床需求的現狀。
來自EvaluatePharma的數據顯示,2015年Vidaza的銷售額為7.60億美元,與2014年基本持平。在擬被納入優先審評程序藥品注冊的6個產品中,與枸櫞酸托法替布片和瑞戈非尼片等產品相比,該產品國內關注度略低。盡管如此,國內目前已有南京聖和、南京華威和杭州容立等企業已獲臨床批文,本品國產化指日可待。
於2011年8月獲美國FDA批準的維莫非尼片(商品名:Zelboraf)是繼美國批準Yervoy後的第二個用於治療黑色素瘤的藥物,上市規格為240mg。維莫非尼適用於具有BRAF V600E基因突變不可切除或轉移性黑色素瘤患者。
維莫非尼是一種選擇性BRAF V600E蛋白突變抑製劑,通過抑製BRAF,阻斷MAPK信號通路,抑製致癌基因活性,從而抑製惡性腫瘤細胞的增殖。臨床試驗證實,與標準化療方案相比,維莫非尼可改善BRAF V600E基因突變型黑色素瘤患者有效率、無進展生存期和總生存率。然而,維莫非尼長期療效並不理想,大部分患者用藥後複發,並發展成耐藥且致死的黑色素瘤。維莫非尼最常見不良反應有角化棘皮瘤和皮膚鱗狀細胞癌,其它不良反應還有皮疹、光敏性增加、關節痛、脫發、疲勞以及心跳異常。
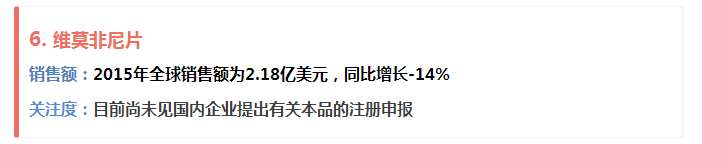
來自EvaluatePharma的數據顯示,2015年維莫非尼全球銷售額為2.18億美元,同比增長-14%。2015年維莫非尼銷售額下滑的主要原因是受百時美施貴寶的Opdivo和默沙東的Keytruda競爭影響。目前,尚未見國內企業向CFDA提出有關維莫非尼片的注冊申報。























 相關新聞
相關新聞