
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




根據《國務院辦公廳關於開展仿製藥質量和療效一致性評價的意見》(國辦發〔2016〕8號)(以下簡稱“8號文”)政策要求,化學藥品新注冊分類實施前(2016年3月)批準上市的仿製藥,凡未按照與原研藥品質量和療效一致原則審批的,均須開展一致性評價。其中,國家基本藥物目錄(2012年版)中2007年10月1日前批準上市的化學藥品仿製藥口服固體製劑,應在2018年底前完成一致性評價。根據CFDA上市藥品數據庫批文數量統計,需要進行一致性評價的仿製藥品約涉及11.6萬個批文,原則上應在2018年前完成一致性評價的仿製藥品涉及17740個批文、1800多家企業,仿製藥一致性評價的時間緊迫。
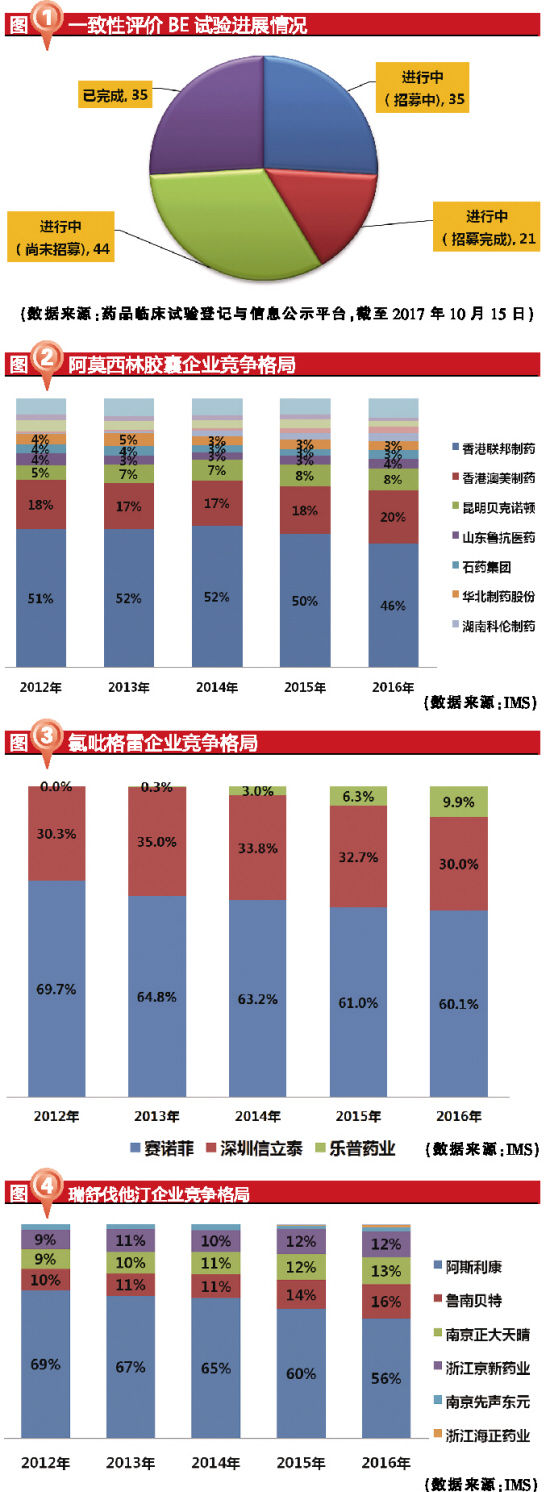
仿製藥一致性評價工作從參比製劑備案到最終獲批預計需要20~28個月,如果按照2016年3月5日國家出台第一份政策文件算起,以2018年底為節點,目前一致性評價賽程已經過半。從BE備案到最終通過一致性評價約需13個月時間,預計多數品種已經或正要進入BE試驗,BE高峰即將來臨。2017年底至2018年初,中國有望迎來第一批通過仿製藥一致性評價的品種。BE試驗約需7個月。
截至2017年10月15日,已有京新藥業的瑞舒伐他汀鈣片(10mg)等35項BE試驗完成。完成BE試驗後,企業將向CDE進行仿製藥一致性評價申請。目前,京新藥業的瑞舒伐他汀鈣片(10mg)、石藥集團的阿莫西林膠囊(0.5g)、信立泰的硫酸氫氯吡格雷片(75mg)、正大天晴的厄貝沙坦氫氯噻嗪片(150mg/12.5mg)與瑞舒伐他汀鈣片(10mg)、揚子江藥業的馬來酸依那普利片(10mg)、江西青峰的恩替卡韋分散片(0.5mg)等多個品種已報送CDE,預計2017年底至2018年初將有第一批仿製藥品種通過一致性評價。
由於優先通過一致性評價的品種將享受優先采購、醫保支付、資金支持等政策支持,因此通過一致性評價的品種有望實現快速放量。筆者認為,大普藥、重磅藥、大領域是三種受到一致性評價政策影響較大的類別。本文選取BE備案企業最多的阿莫西林膠囊、市場超大品種氯吡格雷,以及心血管領域重點品種瑞舒伐他汀為代表品種,對三類產品的特征和未來趨勢進行詳細解讀。
 相關新聞
相關新聞