
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




核查要點有哪些?什麽情形“不通過”?
臨床、研發和生產全方位合規,更重視關鍵細節
12月21日,CFDA官網發布了《仿製藥質量和療效一致性評價研究現場核查指導原則(征求意見稿)》《仿製藥質量和療效一致性評價生產現場檢查指導原則(征求意見稿)》《仿製藥質量和療效一致性評價臨床試驗核查指導原則(征求意見稿)》和《仿製藥質量和療效一致性評價有因檢查指導原則(征求意見稿)》4個指導原則。這4個征求意見稿進一步細化仿製藥質量和療效一致性評價工作申報流程。
從4個征求意見稿的核查要點、判定原則等可以看出,CFDA越來越關注核查中的關鍵細節。特別是:藥品申報中提交的產品生產批次的重要數據完整性;藥品生產過程是否按照藥品申報資料中承諾的要求進行生產;用於生物利用度(或等效性)研究的產品批次或申報提交批次的生產是否遵守GMP;用於生物利用度(或等效性)研究的產品批次或申報提交批次的生產中有無進行處方變更或工藝變更;關鍵臨床試驗用產品批次與新藥申報所提交的批次之間的工藝是否存在顯著差異;公司生產設施是否缺乏生產商業批成品藥或原料藥的能力等。
仿製藥即將進入臨床、研發和生產都追求真實、合規的年代。

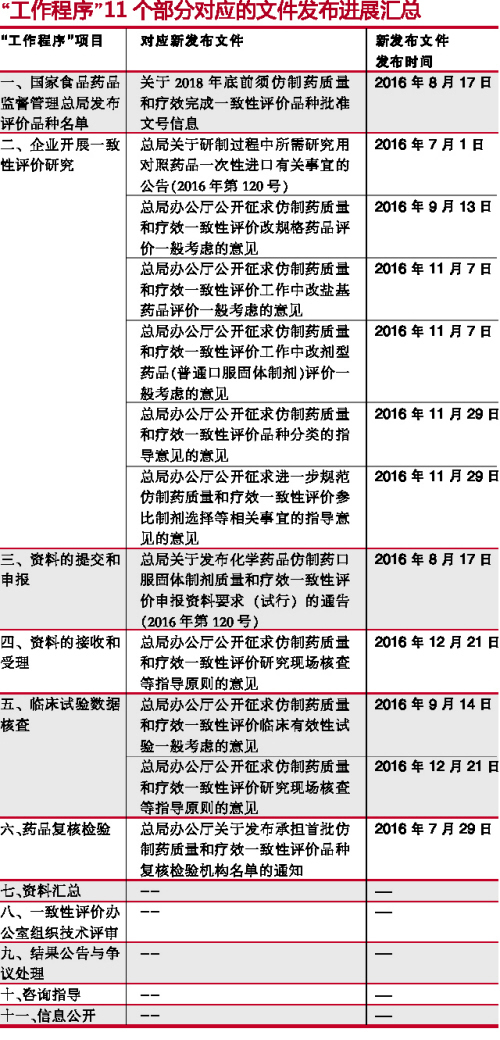
根據《仿製藥質量和療效一致性評價工作程序》(簡稱“工作程序”),一致性評價工作可分為11個部分。2016年5月25日之後,這11個部分對應的文件發布匯總(見下表)可見,目前的文件發布針對從 “國家食品藥品監督管理總局發布評價品種名單”(第一部分)到 “藥品複核檢驗”(第六部分)。實際上,大部分指導原則已經出台,企業應開始有針對性地根據CFDA要求準備資料。
 相關新聞
相關新聞