前 言
近年來生物類似藥(biosimilars)越來越受重視,許多生物製品(如英利昔單抗、促紅細胞生成素Epogen等)的類似藥已在FDA備案,促白細胞生成基因工程藥Neupogen的生物類似藥Sandoz’s Zarxio已於2015年9月在美國上市。
一、什麽是生物類似藥?
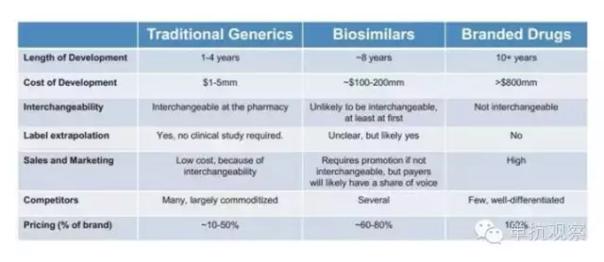
與小分子化藥類似藥相似,生物類似藥是指與上市生物藥品“高度相似”的後續生物產品,但是生物類似藥的結構比化藥仿製藥要複雜得多。因此,生物類似藥市場也與傳統的小分子仿製藥市場不同:生物類似藥市場的門檻更高,需要複雜的技術和更大、更長時間的投資;同時,這個領域的競爭者較少,價格也較穩定;另外,生物類似藥最初不易互相換用。
二、生物類似藥研發分5個階段
蛋白測序是生物類似藥的第一步,蛋白序列必須與原分子精確匹配,不能完全依賴公開發布的數據。糖基化屬性匹配是達到生物相似性的關鍵,這會影響PK/PD性質、安全性和有效性,並且這一步容易受到細胞係和生長環境的影響。第三步是掌握相關知識產權問題,避免後續的麻煩。這前三步都屬於分子選擇階段,即臨床前研發階段。臨床一期的PK/PD研究非常關鍵,對Cmax, AUC0→t等參數都有相關規定。最後是三期臨床確定安全性和有效性。
三、生物類似藥市場動態
J.P.Morgan認為,生物類似藥的時代即將到來。未來十年內將有一大波生物類似藥進入美國和歐洲市場(如Remicade、Neupogen、Epogen等的類似藥),同時相關的管理辦法也會建立和完善。生物類似藥也將為政府稅收創造實質性的貢獻。
(一)生物類似藥市場不是一夜之間蓬勃起來的:
1. 即使是很保守的估計,2025年生物類似藥的市場額將到達200億元
2. 我們預計在美國生物類似藥的價格會下降20%-40%
生物類似藥的價格仍然有爭議,但多位業內人士指出在美國其價格將會下降20%-40%。
美國生物類似藥的價格取決於和納稅人協商的結果
納稅結構的改變可能是導致生物類似藥降價的一個因素
3. 生物類似藥的開發比小分子仿製藥昂貴,這也是決定其定價的一個主要原因。
應臨床試驗的需求,生物類似藥需要更多的研發投入
生物類似藥是不能互相替代的,因此它們需要有銷售基礎設施
但是由於生物類似藥提高其製造工藝,帶來產品的邊際效益。
4. 歐洲市場最終會有25%-45%的價格折扣
在歐洲生物類似藥的價格取決於市場結構
由於國際招標,其市場價格下降30%-40%,這些市場包括波蘭、挪威和匈牙利,選中的市場將有很大的價格跌落
醫院和計劃規定的市場,其價格將下降約25%
5. 這個類別裏有很多大型西方歐盟市場
自由市場大概有20%-30%的折扣
我們希望看到原研生物藥價格能很快下降
6. 有趣的是歐盟生物類似藥在大力推行
隨著非格司亭的生物類似藥(優保津)可使用性,我們看到尤其在歐洲發展中國家市場中,優保津的使用率在不斷提高
沿著這個思路,我們不必驚訝地發現其他生物類似藥市場的不斷擴大
(二)四個因素促使生物類似藥市場的規模擴大
病人的危急程度:極少的危急情況使生物類似藥的使用擴大
快速的反饋:如果藥物的安全性和有效性能有及時的反饋,醫生更願意使用生物類似藥。
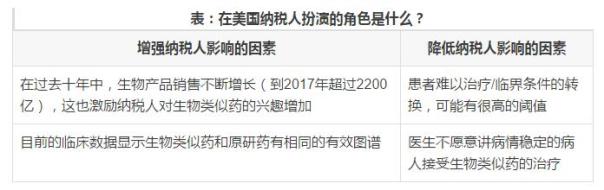
納稅人的影響:納稅人更多地關注生物類似藥,他們也會更願意接受生物類似藥的使用。
終市場的規模:納稅人會將注意力集中在大規模的昂貴的治療項目上。如下表,展示了在美國,納稅人扮演的角色是什麽?
(三)一些生物類似藥公司的特點
我們目前發現了許多顯著的交易和合作夥伴關係:
輝瑞和Hospira的合作推進生物類似藥的發展
Baxalta、Coherus和 Momenta的合作
輝瑞合作開發蘭尼單抗
對於合作出現的利益我們也不會感到驚訝。
四、熱點爭議
生物類似藥領域存在許多熱點爭議問題。
(一)整體監管路徑變得更加清晰
生物類似藥的批準可能需要一項PK/PD研究,大多數情況下指的是臨床III期麵對麵的非劣效性研究。因為我們知道,絕大多數的新藥研發通過成功的I期PK/PD研究降低風險。 在過去幾年,歐盟批準了幾個生物類似藥,而美國也在2015年批準了首個生物類似藥。其中,主要的初期生物類似藥目靶標有Neupogen/Neulasta, Epogen和TNF。一般說來,在適應證的作用機製相似的情況下,我們希望監管機構允許標簽外推。在這一方麵,我們密切關注TNF在美國的動態。然而,我們也不期望在短期內的可交換性。
1. 在大多數情況下我們希望標簽外推
一般來說,在大多數情況下我們希望標簽外推。FDA和EMA允許在不同疾病狀態下成分作用方式相似的藥物進行合理的標簽外推。然而包括幾家大型生物製藥企業在內的許多公司,都隻對一個適應證進行大型的III期試驗。
2. 然而,在不同市場上市的藥物的標簽外推法尚不清楚
有幾個外推尚不清楚的情況,特別是當一個藥物在不同市場上市時。當EMA根據生物類似藥Remicade在類風濕性關節炎的數據批準其所有適應證時,加拿大衛生部考慮到ADCC可能在克羅恩病和潰瘍性結腸炎中發揮作用,而沒有批準該生物類似藥的這些適應證。最近匈牙利在克羅恩病和潰瘍性結腸炎方麵的Inflectra/Remsima有效性數據應該有助於緩解這些問題。而美國的AdCom專門小組對其延期,可能在等待支持外推適應證的數據。生物類似藥Rituxan是另一個爭議情況的代表,目前尚不清楚其在腫瘤方麵的RA數據是否足夠其通過批準。
3. 即使有外推法,數據的缺乏仍可能是一個挑戰
當我們期待標簽外推時,我們看到醫生是以數據為導向的。直到最近,Inflectra(生物類似藥Remicade)在GI適應證(克羅恩病和潰瘍性結腸炎)方麵沒有臨床數據,還受到了來自歐洲的一些腸胃病學家的抵製。出於商業原因,幾個提到過的生物類似藥在進行其他適應證的小型臨床研究。而根據我們的談話所知,醫生更喜歡他們遇到的疾病狀態方麵的數據,但是一般會認為在最難治愈的疾病狀態下的數據也是足夠的。
4. FDA宣布標簽指南
FDA預期將於今年宣布標簽指南。人們關注哪些數據將被包括在內,而哪些又將排除在外;生物類似藥的標簽與原藥分子將有什麽不同。標簽很重要,包括在提供給醫生的詳細數據中,標簽可以用於區分不同的生物類似藥。
5. INN命名約定仍不明朗
生物類似藥物是否會與原藥分子使用相同的INN命名仍未可知。生物類似藥公司希望采用相同的通用INN名,但是原藥公司稱采用不同的命名對於市場後期的安全分析非常重要。FDA建議每個生物類似藥有一個獨特的後綴,但未統一後綴是否須有實義。而歐洲卻支持使用與原藥相同的INN名。然而,我們希望公司為生物類似藥重新命名以更好地支持銷售和市場工作。
6. 我們並不期望在不久的將來出現可替代的生物類似藥
在美國,可替代性的指導方針仍不清楚。FDA計劃在“不久的將來”發行可替代性指導,這將可能涉及轉換研究。可替代性與標簽外推如何貫穿將會很有趣,即生物類似藥在所有適應證上都能替代嗎?而歐盟不允許生物類似藥在藥房的替代。雖然歐盟用“可替代”一詞來形容生物類似藥,但是在沒有處方醫生同意的情況下,生物類似藥不可作為替代藥物。 綜上,我們並不期望在不久的將來出現可替代的生物類似藥。
(二)法律/IP是被低估了風險的障礙
1. IP是一個關鍵的不確定因素
生物類似藥生產商在尋求將產品推廣到市場時麵臨大範圍的出色IP。與列出可能推遲批準通用藥物的產品和專利的小分子橙皮書不同,紫皮書目前隻列出了產品和不適用的專利。生物類似藥企業必須依靠他們自己內部對原藥相關專利的法律進行評估。而這樣的評估可能在很大程度上並不可測,直到351(k) 生物類似藥注冊審批文件的推出,才觸發了BPCIA下創建的專利解決逐步程序。
2. 原藥生產商繼續發布額外的IP文件
原藥生產商繼續申請專利,在專利發行之前可能會有不完整的IP出現。在我們看來,在IP方麵的工作能力是一個關鍵因素,我們將繼續關注對IP的額外描述和不同公司在操控這些專利上的能力。例如,Humira IP estate 包括大約150個專利和50個未決申請,其中半數為配方和成分專利。而進一步的產品線延伸,新配方或組合工作是創新者潛在的生命周期管理工具。
3. BPCIA和訴訟程序中的不確定性
351(k)BLA申請後,BPCIA列出了一個大約250天的程序,在這個程序裏原藥生產商和生物類似藥生產商協商對哪一項專利提出訴訟。值得注意的是,訴訟獨立於FDA程序,並且沒有30個月的保留和三倍的賠償。沿著這些線路,原藥生產商需要尋求阻止生物類似藥生產商啟動程序的禁令。而就算生物類似藥生產商向原藥生產商公開申請失敗,FDA也無權因此拒絕生物類似藥生產商的批準。在Amgen和Sandoz的案例中,法院裁決讚成Sandoz,意味著生物類似藥公司可以選擇是否參與BPCIA專利交換程序。
4. 從最近和正在進行中的訴訟中獲得的啟示
Amgen v. Sandoz: 法院裁決表明生物類似藥生產商可以選擇是否參與BPCIA專利交換過程。然而,法院裁定在這種情況下,Sandoz在生物類似藥批準後,而非批準前,給出180天的商業營銷通知。一些專家認為,這一裁決可能特定於這一事實模式(即Sandoz不參與專利交換程序),並期待在未來案例中有潛在更新。 其他案例: AMGN v. Apotex and JNJ v. HSP/Celltrion: 在兩個案例中,生物類似藥生產商均作為申請人參與專利交換程序 JNJ v. HSP/Celltrion:Celltrion半途提前終止其專利交換程序,並迫使Janssen提出訴訟 AMGN v. Apotex: 也包括138個製造專利,Coherus聲稱其並不構成侵犯。
5. 專利訴訟時間
傳統的專利訴訟時間大約4-5年,多方複審時間大約2.5年。在沒有高危發行的情況下,即使IP有效,專利訴訟和/或多方複審可能會對預期的發行時間增加2.5-5年。比如Humira的類似藥至少要在2018年的年中才能進入市場。
五、一些生物類似藥的典型案例
1. 抗TNF生物藥:新患者的出現發推動生物類似藥的應用
我們預測大多數新患者將采用生物類似藥治療
但是,我們認為(至少在初期)將傳統藥物治療穩定的患者轉向生物類似藥治療是很困難的TNF生物藥市場中有很多病人是來自傳統藥物治療很多年的患者。根據醫生和納稅人的對話,我們認為在最初幾年將病人治療從傳統模式轉換到生物類似藥的治療是很困難的。盡管一些生物類似藥研發的團隊正在研究適用傳統藥物的病人是否可以轉換到生物類似藥,醫生做出這種決定需要更長期的結果。
2. 抗TNFs:歐洲的經驗
韓國的Hospirahe 美國的Celltrion聯合開發的Inflectra/Remsima(生物類似藥是Remicade)去年在歐洲市場占有率達到20%,並在2015年二月份擴大。
大部分市場可見30%的價格降低,在一些特殊地區的市場(挪威、芬蘭)可以見到價格急劇下降。生物類似藥的早期市場中,默克公司發現一些患者從傳統治療向生物類似藥的治療轉變,並且保持著生物類似藥的治療,可見這是一個很大的市場。
3.抗TNFs: 潛在的阿達木單抗商業戰爭
在生物類似藥的世界,艾伯維參考了阿達木的特許經營商業策略。阿達木單抗的適用人群廣是一個競爭優勢,尤其體現在其患者都是長期使用的穩定的群體。由於群體大,艾伯維可以提供回扣,從而對納稅人有利,即使和群體少但價格便宜的生物類似藥相比也很有競爭優勢。結果是,艾伯維在市場上占據有利地位。
另外,我們預測除了類風濕性關節炎和牛皮癬,仍有超過40%的患者使用阿達木單抗,這也是限製了生物類似藥使用的主要原因。
據我們所知,生物類似藥公司正在對類風濕性關節炎和牛皮癬進行臨床III期的實驗。即使生物類似藥被授予安全可靠的標簽,醫生在使用這些藥物時還是以臨床數據為主要依據,從而臨床數據是決定生物類似藥使用的關鍵因素。
4.抗TNFs:阿達木的新製劑提供了額外的市場保護
艾伯維開發新的製劑,在申請FDA和EMA,並且在不斷地開發新設備。申請專利建議新製劑可能涉及到室溫穩定性,注射部位低反應性,高劑量,以及無針設備。我們關注新製劑的更新,在2015年可能會被審批。新製劑是否可以提高患者的治療體驗,艾伯維將會有多少患者群體的轉換,以及新製劑是否可以保護阿達木的特許經營,這些都是不清楚的。
5.G-CSGs:我們期望生物類似藥有顯著的市場侵入率
和TNFs不同,我們期望G-CSFs生物類似藥有一個較廣的市場占有率。
G-CSFs的使用比較短,因此醫生/納稅人能更輕鬆的切換患者群體。
另外幾個因素也說明這個家族的生物類似藥市場比重高G-CSFs是通過醫院渠道,因此成本導向的GPOs就有舉足輕重的地位。市場中有相當一部分費用可通過醫保B部分報銷,醫生切換到生物類似藥就有額外費用獎勵。
6.G-CSFs:歐洲得出的經驗
在歐洲,非格司亭(優保津)生物類似藥已經占據超過50%的短效G-CFS市場,五年之內,非格司亭的市場占有率將超過75%。
在歐洲,山德士的Zarzio有超過30%的患者群,超過了優保津。
另外,我們發現隨著藥物價格的降低,使用G-CSF的人群在擴大。
7.G-CSFs:在美國Granix啟動的趨勢
Teva公司的Granix(TBO-非格司亭)在2012年被批準作為一種新型的生物藥物(作用35(a)途徑)
根據艾美仕市場研究公司調查,Granix去年已經產生了125百萬美元的盈利。
價格相當於優保津25%的折扣價,並且占據25%的銷售市場。
不符合外推,僅允許非骨髓惡性腫瘤患者接受化療時用來減少中性粒細胞。
8.G-CSFs:醫療B部分的報銷會擴大該類藥的市場占有率
健康與人口服務部最近在支持退出B部分的生物類似藥的報銷指南。
“美國銷售價格+6”報銷政策推動G-CSFs的市場擴大。 若美國銷售價格可行,那麽生物類似藥的醫療報銷可以達到其WAC的106%。在美國銷售價格實施之後,醫療報銷可以達到生物類似藥美國銷售價格的100%和參考產品價格的6%。















 相關新聞
相關新聞