7月21日,CFDI官網發布了《藥物臨床試驗數據核查階段性報告(2015年7月-2017年6月)》,對兩年來藥品臨床試驗數據的核查工作進行了階段性總結。
1、品種填報及撤回情況
截止到 2017年6月底,總局共發布7期公告,決定對2033個已申報生產或進口的待審藥品注冊申請開展藥物臨床試驗數據核查。其中,申請人主動撤回的注冊申請 1316個,占64.7%;申請減免臨床試驗等不需要核查的注冊申請258個,占12.7% 。
2、核查結果處理情況
在已核查的313個藥品注冊申請中,有38個注冊申請的臨床試驗數據涉嫌數據造假,其中新藥注冊申請16個,仿製藥注冊申請17個,進口藥注冊申請5個。總局已發布公告,對其中30個注冊申請作出不予批準的決定,並對其中涉嫌數據造假的11個臨床試驗機構及合同研究組織(CRO)予以立案調查。其餘8個注冊申請的核查資料正在按程序處理。
3、發現主要問題
(一)現場核查發現缺陷的總體情況
經對313個藥品注冊申請的現場核查報告進行分析,共發現5111條缺陷項。其中臨床部分4583條,平均每個臨床試驗機構發現問題6條;生物分析部分528條,平均每個生物樣本分析單位發現問題4.4條。
依據《藥物臨床試驗數據現場核查要點》對缺陷進行分類,發現缺陷條款數量最多的部分依次為:臨床試驗過程記錄及臨床檢查、化驗等數據溯源方麵(占 28.1%)、 方案違背方麵(占 12.0%)、試驗用藥品管理過程與記錄方麵(占 11.6%)和安全性記錄、報告方麵(占 10.1%) ,共發現缺陷3161項,占61.8%(見圖 1) 。
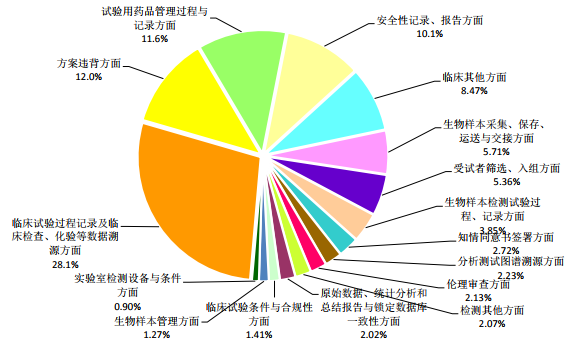
圖 1. 核查缺陷分布情況
(二)高頻次缺陷條款分布情況
對臨床部分現場核查發現的4583項缺陷匯總分析,頻次最高的缺陷條款見圖 2。
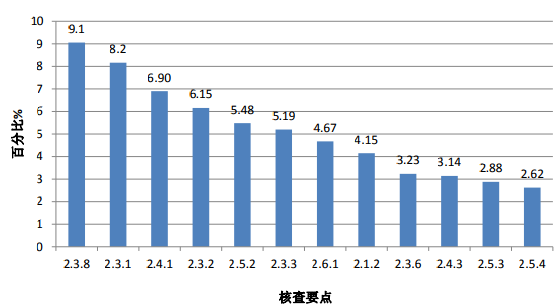
圖 2. 高頻次缺陷條款分布情況(臨床部分)
對分析測試部分現場核查發現的528項缺陷匯總分析,頻次最高的缺陷條款見圖 3。
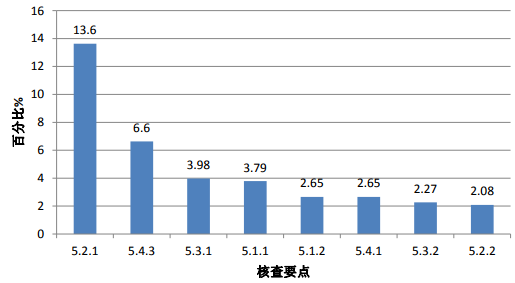
圖 3. 高頻次缺陷條款分布情況(分析測試部分)
(三)發現主要問題
1. 臨床試驗過程記錄及臨床檢查、化驗等數據溯源方麵。
受試者體檢單上性別欄顯示為男性,但 X 線片圖像顯示為女性;
報告單總的報告時間和人員信息被裁掉;
脈搏治療前後一致,不合常理;
研究病曆顯示受試者已死亡,仍繼續有訪視記錄和檢驗報告;
多例受試者試驗的血生化化驗單中的部分數據(主要為肝腎功能指標)與醫院 LIS 係統中的數據存在嚴重差異;
臨床試驗僅有病例報告表,無原始病曆記錄;
數據不可溯源,受試者血常規、尿常規等數據無法溯源;
不同受試者入出組的血生化報告值完全相同;
心電圖圖譜、報告真實性存疑,同一受試者試驗前後波形不一致;
主要療效指標、次要療效指標無法溯源等等。
中心實驗室樣品放置時間超過樣品在該條件下的穩定時間;
樣品運輸過程中無溫控記錄;檢測報告單上無檢測人和複合人的簽名;
樣品報告時間與樣品接收間隔數天;
樣品被連續轉包導致檢測周期過長等。
2. 方案違背方麵。
修改入組檢查結果,使其符合方案規定入組標準;
漏記方案規定禁用藥物、合並用藥;
給藥方式、給藥劑量及采血時間偏離試驗方案;
未按方案隨訪至規定日期等。
3. 試驗用藥品管理過程與記錄方麵。
試驗用藥品不真實,參比製劑的包裝規格和藥片外觀與試驗製劑完全一致;
直接將試驗製劑用作參比製劑,造成兩者等效的假象;
藥品發放和回收數量不一致;
藥品管理員未被授權;
藥品運輸過程中的溫度超出規定溫度;
無藥品回收記錄;
藥品接收和發放記錄單無藥品批號或批號不一致;
藥品發放記錄單中修改不規範等。
4. 安全性記錄、報告方麵。
發生AE,CRF和總結報告中未錄入;
修改AE與試驗藥物相關性的判斷;
未按規定上報 SAE;
AE 漏記等。
5. 生物樣本檢測試驗過程、記錄方麵。
儀器還未購買就有了檢測數據;
缺乏生物樣本預處理、保存、轉運以及 LC-MS/MS 、離心機使等關鍵部分的記錄;
樣本分析過程記錄原始記錄缺失,相關記錄為事後整理補充填寫,分析過程記錄等是後期整理得到,沒有原始分析記錄;
隱瞞棄用試驗數據,原始記錄本中未記錄;
圖譜文件與血樣沒有關聯性,兩者之間的聯係可隨意更改且無法追溯;
部分報告數據與原始圖譜計算所得數據不一致;
存在不合理手動積分等。
6. 分析測試圖譜溯源方麵。
方法學驗證及生物樣本測試的稽查軌跡中均多處出現分析測試係統日期反複更改、重複檢測後用同一文件名命名並覆蓋原有圖譜;
從質譜圖譜中發現選擇性使用符合要求的標準曲線和質控樣品,並在 Audit trail 中發現將被采用的樣本的序號( Sample ID )修改成連續序列;
多個時間點樣品編號與對應的圖譜中的文件名編碼從小到大的順序顛倒;
部分受試者分析序列采集過程有中斷,質控樣本重複進樣,部分樣本重分析而沒有隨行質控,但數據被采用;
多個樣本測試數據文件的采集時間有重疊;
儀器被轉賣,分析測試圖譜無法溯源;
選擇性使用數據;
分析測試圖譜無法溯源等。
原文詳見CFDI審核查驗中心http://www.cfdi.org.cn/resource/news/9136.html

















 相關新聞
相關新聞