
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com





2023年IASLC世界肺癌大會(WCLC)將於9月9~12日舉行。作為肺癌領域全球規模最大的學術會議之一,大會致力於探討肺癌及其他胸部惡性腫瘤的前沿診療進展,納入多項重磅研究。
8月16日,2023WCLC已在大會官方網站披露可公布的摘要。hjc黄金城Marketing梳理了有關“魔法子彈”ADC藥物的相關報告,圍繞HER3、TROP-2等熱門靶點的多項研究數據將於大會公布。

摘要號:OA05.03
標題:Patritumab Deruxtecan (HER3-DXd) in EGFR-Mutated NSCLC Following EGFR-TKI and Platinum-Based Chemotherapy: HERTHENA-Lung01
講者:H.A. Yu| Department of Medicine, Medical Oncology, Memorial Sloan Kettering Cancer Center, New York/NY/USA
口頭報告時間:September 10, 2023 at 3:02 PM UTC +8,10m
HER3-DXd(Patritumab Deruxtecan,U3-1402)是一種新型的HER3靶向ADC藥物,由一個全人源化HER3單抗,通過穩定的四肽可裂解連接子與拓撲異構酶I抑製劑的有效載荷相連。
這項開放標簽試驗隨機納入了既往接受過EGRF-TKI和鉑類化療的晚期EGRF突變NSCLC患者,並分別接受兩種劑量方案:推薦劑量組(5.6mg/kg IV Q3W)或劑量遞增組(3.2-4.8-6.4 mg/kg)。
推薦劑量組入組已達目標,而基於I期數據的效益-風險評估,劑量遞增組的入組提前停止。
本試驗的主要終點是根據 RECIST 1.1 版通過盲法獨立中心審查 (BICR)確認的客觀緩解率(ORR)。
5.6 mg/kg組中,共225例患者接受了HER3-DXd給藥。截至2022年11月21日,中位試驗持續時間為13.1個月,範圍:9.0-21.6個月;中位治療持續時間為 5.5 個月,範圍:0.7-18.2個月。
經BICR評估:cORR為28.4%;中位DOR為6.0個月;中位PFS為5.5個月;中位OS(初步)為11.9個月。
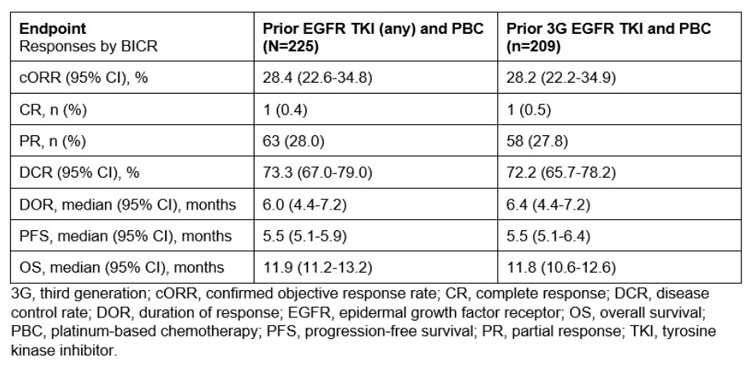
數據顯示,既往接受過奧希替尼治療的患者臨床獲益結果相似。此外,在不同HER3表達和多種EGFR-TKI 耐藥機製中均觀察到臨床活性。
在基線時未經放射治療的腦轉移患者(n=30)中,經BICR確認的CNS ORR為36.7%(95% CI,19.9%-56.1%;CR: 10/30,PR: 1/30)。
與之前的觀察結果一致,不良事件(AEs)可控且可耐受:10例患者(4.4%)因藥物相關AEs停藥,4例患者(1.8%)死亡;45.3%的患者出現≥3級藥物相關 AEs;12例患者(5.3%)出現獨立判定的藥物相關間質性肺病(1/2級,n=9;3級,n=2;5級,n=1)。
HER3-DXd的療效具有臨床意義,且該研究首次報道了在中樞神經係統(CNS)的療效。HER3-DXd很可能成為EGFR-TKI治療後進展或不同耐藥突變患者的前景療法。目前,針對經EGFR-TKI治療後進展的EGFR突變NSCLC患者的III期試驗HERTHENA-Lung02(ClinicalTrials.gov, NCT05338970)正在進行中。
摘要號:OA05.04
標題:Sacituzumab Govitecan + Pembrolizumab in 1L Metastatic Non-Small Cell Lung Cancer: Preliminary Results of the EVOKE-02 Study
講者:B.C. Cho| Yonsei Cancer Center, Yonsei University College of Medicine, Seoul/KR
口頭報告時間:September 10, 2023 at 3:12 PM UTC +8,10m
以程序性死亡受體1(PD-[L]1)抑製劑為基礎的治療方案是轉移性非小細胞肺癌(mNSCLC)的一線標準治療方案,本次研究圍繞改善療效的聯合治療方案展開。
Sacituzumab govitecan(SG)是一種靶向TROP-2 的ADC藥物,其臨床顯示活性且安全性可控。這項正在進行的全球開放標簽、多隊列、2 期 EVOKE-02 研究(NCT05186974)評估了SG + Pembrolizumab(Pembro)±鉑類藥物作為 mNSCLC 一線治療效果。本次報告將解讀兩組不同PD-L1腫瘤比例評分(TPS)區間的患者治療的初步結果。
本試驗終點包括客觀反應率(ORR;根據 RECIST v1.1)、無進展生存期、反應持續時間、疾病控製率、總生存期和安全性。
試驗隊列分為:隊列A,TPS≥50%;隊列B,TPS<50%。試驗以21天為1周期,患者分別在第1天和第8天接受SG 10 mg/kg治療,並在第1天接受Pembro 200 mg治療。
截至2023年1月13日,共44名患者(隊列A:16例;隊列B:28例)入組並接受治療。
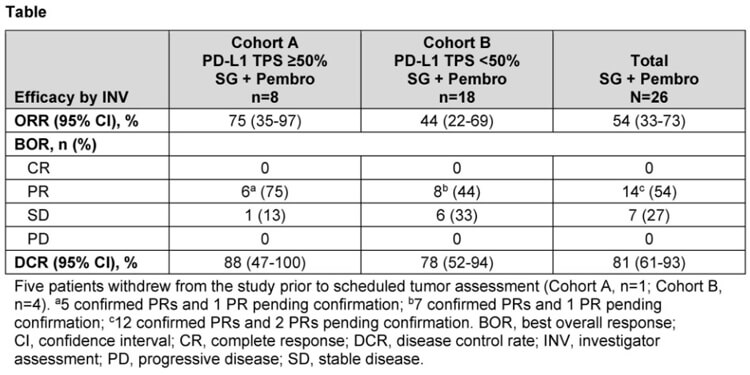
在療效有效的患者*(隊列A:8例;隊列B:18例)中,經評估,隊列A的ORR為75%(5例證實PR,1例有待證實的PR),隊列B的ORR為44%(7例證實PR,1例有待證實的PR)。
注*:療效結果報告隨訪時間≥13.0周的療效有價值的患者)
在安全性有效的患者**(44 例)中,突發不良事件(TEAEs)發生率為 96%(3/4級,52%)。
最常見的任意級別TEAE為腹瀉(50%)、貧血(41%)、虛弱(36%)和中性粒細胞減少(32%)。導致停藥的TEAE發生率為7%。此外,有3例(7%)患者因 TEAE死亡,隻有1例(2%)被認為與研究治療有關。
注**:安全性結果報告接受了≥1個劑量研究治療的安全性有價值的患者
在本次試驗中,SG + Pembro的聯合治療方案在mNSCLC患者的一線治療中顯示了鼓舞人心的早期療效,安全性可控,且與每種藥物的已知安全性一致。隨後,研究團隊將陸續公布對更多患者和更長時間的隨訪結果。
摘要號:OA05.05
標題:Ifinatamab Deruxtecan (I-DXd; DS-7300) in Patients with Refractory SCLC: A Subgroup Analysis of a Phase 1/2 Study
講者:M. Johnson| Sarah Cannon Research Institute, Nashville/TN/USA
口頭報告時間:September 10, 2023 at 3:22 PM UTC +8,10m
B7同源物3(B7-H3)是一種I型跨膜蛋白,65%的小細胞肺癌(SCLC)患者體內有中度到高度的B7-H3過表達。
I-DXd 是一種新型B7-H3靶向的ADC藥物,它利用了經過臨床驗證的Deruxtecan (DXd) 技術,結合了血液循環穩定性的連接子和強效拓撲異構酶 I 抑製劑有效載荷。
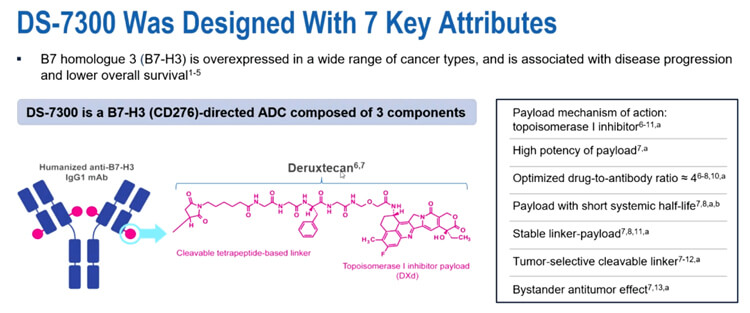
在ESMO 2022,研究團隊曾發布了針對經多線治療的晚期實體瘤患者的1/2期試驗相關結果。本次報告將圍繞接受I-DXd治療的SCLC患者進行的中位11.7個月隨訪展開分析,包括反應率、無進展生存期 (PFS) 和總生存期 (OS) ,並基於B7-H3表達的療效分析。
而亞組分析主要針對1/2期試驗第一部分的SCLC亞組,試驗包括未經B7-H3表達篩選的經多線治療晚期實體瘤患者。療效和安全性分析包括接受4.8至16.0毫克/千克劑量I-DXd治療的SCLC患者。
截至2023年1月31日,21例SCLC 患者的安全性、反應、PFS 和 OS 均可接受評估。目前還有2例患者仍在接受治療。患者既往接受治療的中位數為2次(範圍:1-9次);大多數曾接受含鉑化療和免疫療法。
安全性與之前的報告一致。
截至2022年6月30日,16例患者可進行B7-H3分析評估。在所有可評估的參與者中,B7-H3的表達水平為中度至高度。研究團隊未觀察到最佳緩解或腫瘤縮小與B7-H3陽性或強度之間的關聯趨勢,仍需要更大的樣本量來證實這些結果。
B7-H3相關性的最新分析結果將在大會上公布。
I-DXd在經多線治療SCLC患者中表現出了強大而持久的療效。同時,它的耐受性和毒性也在可控範圍內。目前,針對二線或三線廣泛期SCLC患者的II期試驗(NCT05280470)正在進行中。
摘要號:OA05.06
標題:Datopotamab Deruxtecan (Dato-DXd) + Durvalumab ± Carboplatin in Advanced/mNSCLC: Initial Results from Phase 1b TROPION-Lung04
講者:K.P. Papadopoulos| START San Antonio, San Antonio/TX/USA
口頭報告時間:September 10, 2023 at 3:32 PM UTC +8,10m
Dato-DXd是一種靶向TROP-2的ADC藥物,其在單藥治療和與抗PD-1±鉑類化療的聯合治療中均顯示出令人鼓舞的早期療效和安全性。
TROPION-Lung04(NCT04612751)是一項針對晚期/轉移性NSCLC的1b期、多中心、開放標簽、劑量遞增/確認和擴展研究。本次報告將對該試驗的1-4隊列的首批數據進行中期分析。患者接受Dato-DXd(4 mg/kg,隊列1/3;6 mg/kg,隊列2/4)聯合度伐利尤單抗(1120 mg,所有隊列)+最多4個周期的卡鉑(AUC 5,隊列3/4),Q3W,直至疾病進展(RECIST v1.1)或發生毒性不耐受。隊列1中的患者和隊列2中的1例患者接受過≥1次含鉑化療方案和抗PD-1/PD-L1治療。
在劑量遞增/確認試驗中,隊列1~4采用改良毒性概率間隔-2(mTPI-2)設計,由3-6名患者依次進行。
該試驗的主要終點為藥物安全性/耐受性,次要終點則包括研究者評估的客觀反應率(ORR)和疾病控製率(DCR) (RECIST v1.1)。
截至2023年3月6日,試驗內共38名患者療效可評估。其中,隊列4中兩名患者報告了DLT(3級[G3]發熱性中性粒細胞減少症1例;G3 斑丘疹和口腔炎1例,並導致第2周期延遲2周以上)。
在隊列2/4中,患者腫瘤細胞的PD-L1表達情況如下:
<1%:31.6%/42.9%、1-49%:31.6%/21.4%,和≥50%:36.8%/35.7%。
隊列2/4患者治療周期的中位數為8.0周(範圍:1-16)/8.5周(範圍:2-16);31.6%/50.0%的患者在DCO時仍在接受治療。
隊列2的一線治療患者(14 人)中,ORR為50.0%(7例確診PR),DCR:92.9%;
隊列4的一線治療患者(13 人)中,ORR為76.9%(9例確診PR,1例在DCO後確診PR),DCR:92.3%。
數據顯示,所有PD-L1表達水平的患者均出現了應答,且三聯療法的應答率普遍優於雙聯療法。
100%/42.1%(隊列2)和100%/71.4%(隊列4)的患者發生了治療突發不良事件(TEAEs;全等級/G≥3)。
最常見的TEAEs如下:隊列2中的便秘(57.9%/0)、口腔炎(52.6%/10.5%)、脫發(52.6%/0)、惡心(42.1%/0);隊列 4 中的口腔炎(64.3%/7.1%)、脫發(57.1%/0)、惡心(57.1%/0)、貧血(50.0%/35.7%)。在隊列 2/4 中,分別有 21.1%/21.4%和 15.8%/35.7%的患者出現導致治療中止和 Dato-DXd 劑量減少的 TEAEs。無治療相關死亡。
Dato-DXd聯合度伐利尤單抗±卡鉑在晚期/轉移性NSCLC患者治療中,表現出了安全性可控及優秀的抗腫瘤活性。
ADC藥物已在乳腺癌等實體瘤治療領域中逐步突破“壁壘”。期待即將在2023WCLC披露的研究數據,將“魔力子彈”攻克肺癌及其難治亞型的進展推向下一浪,實現更多肺癌患者獲益。
hjc黄金城在ADC的臨床前一體化研究方案製定中與客戶深入交流,科研骨幹將每一個案例的特點與多年實戰經驗和技術積累相結合,謹慎地將優質實驗方案與結果提交到客戶手上。hjc黄金城可以為客戶提供ADC Payloads合成、ADC藥物偶聯、ADC藥效學評價、ADC藥代動力學評價和ADC安全性評價等服務。
截至2022年末,hjc黄金城已成功助力12個ADC藥物獲批臨床,並有10多個ADC項目在研。
2023WCLC官網公布報告摘要,鏈接:https://cattendee.abstractsonline.com/meeting/10925/Session/90
如您對本期話題有進一步想要了解的內容,或您希望hjc黄金城Marketing討論更多行業資訊,歡迎關注“hjc黄金城Marketing”公眾號,給我們互動。期待您的"美"思妙想~
 相關新聞
相關新聞