抗體藥物偶聯物(ADC)是近年來腫瘤治療研究的焦點。ADC 的作用機製很複雜,通常需要藥物內化,然後進行細胞內處理和有效載荷釋放。與腫瘤學中使用的許多標準療法不同,ADC 必須作用於腫瘤細胞才能獲得最佳效果。ADC 的藥效學特性使其特別適合用於治療難治性癌症。所以,ADC理所當然地成為腫瘤學中增長較快的藥物類別之一。
hjc黄金城擁有高水準的專業技術和豐富的ADC項目經驗,可為國內外客戶提供符合中國和美國新藥申報要求的臨床前藥效、藥代動力學和安全性評價服務以及一體化的IND申報注冊服務。
>>更多閱讀:hjc黄金城ADC臨床前研究解決方案

ADC藥物簡介
目前,許多 ADC藥物已顯示出治療難治性癌症的活性,從而獲得了眾多不同適應症的批準。然而,它們的更廣泛應用受到各種挑戰的限製,包括毒性、預測性生物標誌物等等。ADC 的功效取決於抗體特異性、連接子特異性和有效載荷特異性因素,每個因素影響著 ADC 與腫瘤各組分及腫瘤微環境 (TME) 之間複雜的相互作用。
近幾年,ADC 藥物不斷取得突破性進展。ADC 藥物的研發也進入了黃金時代。未來 5-10 年 ADC 藥物的全球市場銷售額將會達到近200億美元。
ADC結構及作用機製
抗體藥物偶聯物 (ADC) 包括三個主要成分:抗體(antibody)、連接子 (linker)和有效載荷 (payload)。
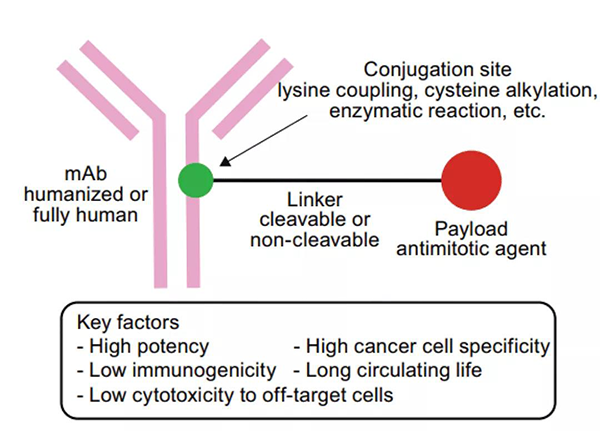
ADC藥物結構[1]
ADC 作用的典型模型假設如下:mAb 與目標抗原的結合,隨後內化,經內體運輸進入溶酶體,在溶酶體中ADC的連接子或抗體部分降解並釋放出有效載荷,有效載荷則進一步發揮作用產生細胞毒性進而殺死腫瘤細胞。但實際情況更為複雜,並且 ADC 之間存在明顯差異。
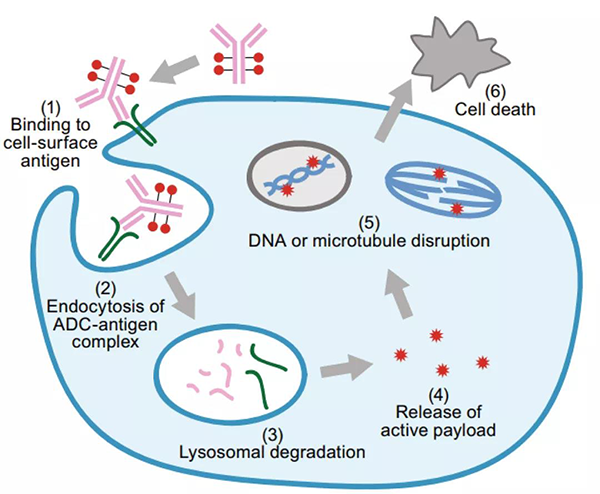
ADC藥物作用機製[1]
抗體
基於抗體的藥物出現使得癌症、自身免疫性疾病、心血管疾病、良性血液病和骨骼疾病等多種疾病的治療取得了實質性進展。抗體片段和雙特異性抗體為創新療法提供了很有潛力的治療前景。抗體需要滿足高特異性、強靶點結合能力、低免疫原性、低交叉反應活性,以達到腫瘤細胞對ADC藥物更高效的攝入和ADC藥物在血清中更長的半衰期。免疫球蛋白 G (IgG) 是ADC 中使用的主要抗體骨架。所以,臨床和臨床前研究的ADC藥物通常選擇IgG作為靶向目的抗原的抗體。
IgGs 可分為四個亞型:IgG1、IgG2、IgG3 和 IgG4 。其中, IgG1由於能夠較好地平衡長血液半衰期和強免疫激活的關係,並且有著較高的自然豐度,是被研究和采用最多的ADC抗體。IgG4由於較低的免疫激活效應也經常被采用在一些對免疫原性反應要求較高的ADC藥物設計中。
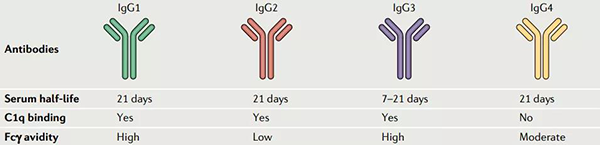
不同IgG對比[2]
有效載荷(Payloads)
早期的
ADC藥物設計旨在攜帶具有已知抗癌活性的傳統化療藥物,例如甲氨蝶呤、多柔比星或長春花生物堿。然而,這些 ADC 並不比它們的小分子細胞毒性藥物更有效,有時需要極高的活性劑量,這反而增加了毒性。數據表明,隻有很小一部分腫瘤靶向的 mAb 的給藥劑量到達腫瘤組織(大約 0.1%),這意味著需要具有更大細胞毒性的有效載荷才能實現治療效果。對攜帶高效化療藥物(如澳瑞他汀類、卡奇黴素類、美登素類和喜樹堿類似物)的 ADC 進行實驗,這些高效化療藥物在亞納摩爾濃度下可能具有細胞毒性。
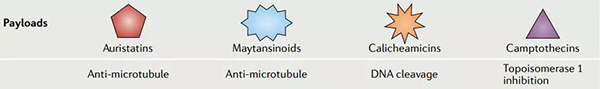
ADC 藥物的有效載荷[2]
小分子藥物的選擇
澳瑞他汀包括單甲基澳瑞他汀 E (MMAE) 和單甲基澳瑞他汀 F (MMAF),它們是微管去穩定劑。卡奇黴素,如奧佐米星,是一種 DNA 結合化合物,可導致雙鏈 DNA 斷裂。美登素類化合物,例如 DM1,來源於美登素,並與微管蛋白結合,從而破壞微管動態不穩定性。喜樹堿類似物,包括依喜替康衍生物 DXd 和伊立替康代謝物 SN-38,可抑製拓撲異構酶 I (TOPO1),導致 DNA 斷裂。
現在選擇小分子藥物時首先要求小分子藥物 IC50值低至納摩爾級別乃至皮摩爾級別。除需要較低的 IC50值以外,通常還需要小分子藥物還包括以下幾點:
1.在與抗體偶聯後不易引起ADC藥物發生聚集以保證在體內擁有較長的循環時間;
2.本身以及形成後的ADC藥物需具有較低的免疫原性;3.在水溶液(血液)中足夠穩定且具有合適的反應位點通過連接子與抗體偶聯,偶聯後仍然能夠保證其生物活性;5.可以通過相對具有經濟效益的過程合成。
連接子(Linkers)
自 ADC 開發早期以來,Linker 技術取得了長足的進步。Linker的設計具有雙重目的:
1、確保當藥物在血漿中循環時,細胞毒性有效載荷仍然牢固地附著在抗體部分上。在血漿中不穩定的連接子可能會過早釋放有效載荷,導致過度的全身毒性和腫瘤部位抗原接合時有效載荷的傳遞減少。考慮到許多 ADC 攜帶具有毒性特征的高效細胞毒性有效載荷,這使得它們不適合全身給藥,因此這個問題尤其重要。
2、確保有效載荷在腫瘤內有效釋放,尤其是在癌細胞內。不能正確傳遞其有效載荷的 ADC 則失去了相對於裸抗和傳統細胞毒性藥物的獨特優勢。
理想的連接子應在血液循環中十分穩定,以避免小分子毒素提前釋放損傷正常的組織或細胞。同時,在腫瘤細胞內需能快速且有效地釋放有效載荷。
連接子主要有兩種類型:可裂解型 (cleavable)和不可裂解型 (non-cleavable)。
可裂解型的連接子又可以分為:酸可裂解的、可還原的和蛋白酶可裂解的。
不可裂解連接子的實例包括硫醚連接子(如在 T-DM1 中使用)和基於馬來酰亞胺的連接子(如在 Belantamab mafodotin 中使用)。在實際使用中,可裂解連接子在循環中表現出不同程度的穩定性,並且會隨著時間在血漿中降解。相比之下,不可裂解的連接子在血漿中往往更穩定,但依賴於整個抗體 - 連接子構建體的溶酶體降解來釋放其有效載荷,通常導致有效載荷上帶電氨基酸的保留,這可能會影響其作用或細胞通透性。
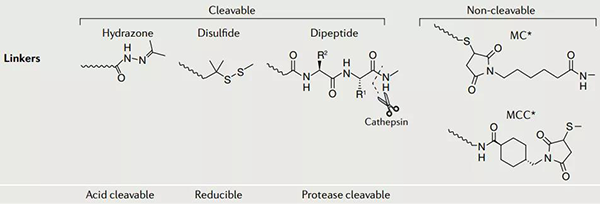
ADC 藥物的連接子[2]
hjc黄金城可以對高細胞毒的分子設計以糖取代 PEG 為水溶性的連接子(Linker),能快速製備高細胞毒的化合物、雙功能團的連接子,實現快速與毒素、抗體連接。
藥物抗體比(DAR)
藥物抗體比 (DAR) 是連接到每個 mAb 的有效載荷部分的平均數量,可通過HPLC-MS等測試方法獲得。DAR對藥物藥理學和活性有影響,DAR值對ADC藥物研發後期階段是必不可少的。ADC藥物在體內循環過程中被腫瘤細胞攝入數量有限,因此通常較高的DAR有利於提高效力。然而ADC藥物中采用的小分子藥物有著較強的疏水性,DAR值過高時會引起ADC藥物聚集,導致在體內循環半衰期減少以及毒副作用提高,這就導致過高的DAR不可取,臨床前和臨床用ADC一般DAR值在2-8範圍。為獲得更高DAR以及均一性的ADC藥物,可通過基因工程對抗體進行改造使抗體具有數量固定並且高效的反應位點用於偶聯小分子藥物。
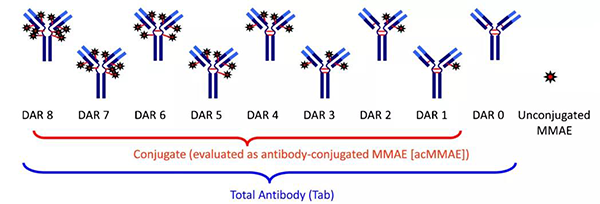
藥物抗體比 (DAR)[3]
總結與展望
ADC 作為一種新型靶向的抗癌藥物,結合抗體和小分子藥物兩者優點,擁有巨大的市場前景。隨著抗體的發展、連接子不斷的優化、高活性載荷的發掘和偶聯技術的不斷完善,高效低毒的 ADC 藥物將會不斷湧現。如果能夠更好地理解和利用 ADC 與腫瘤相互作用的微妙之處,則ADC技術的真正潛力會更好地發揮和更廣泛地應用,最終可能對腫瘤患者的治療產生變革性影響。
參考文獻
[1] Kyoji Tsuchikama,et al. Antibody-drug conjugates: recentadvances in conjugation and linker chemistries. Protein Cell. 2018Jan;9(1):33-46.
[2] Joshua Z Drago,et al. Unlockingthe potential of antibody-drug conjugates for cancer therapy. Nat Rev Clin Oncol. 2021 Jun;18(6):327-344.
[3]Dan Lu, et al. Semi-mechanistic Multiple-Analyte Pharmacokinetic Model foran Antibody-Drug-Conjugate in Cynomolgus Monkeys.Pharm Res. 2015Jun;32(6):1907-19.
聯係我們:
電話: +86 (21) 5859-1500(總機)



















