
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




藥物研發的主要思路是通過藥物來抑製或激發疾病發病機製中的某一個靶點。但是,近年來係統生物學為不斷發展的藥物研發提供了一種新的思路:多靶點藥物治療。同時,對疾病發病機製的進一步研究和認識也表明了,單獨靶點的抑製或激發,在複雜疾病治療中有局限性。多靶點藥物治療,可使藥物同時作用於多個靶點,對各靶點的作用可以產生協同效應,使總效應大於各單效應之和,達到最佳的治療效果。
多靶點藥物的概括
多靶點藥物按組分的不同可以分為三種形式。其一為:多種藥物聯合用藥,缺點是所含藥物彼此間容易發生相互作用而產生不良反應。其二為:多組分單藥片,即在一個給藥單位中含有多種活性組分。其三為:某一單組分藥物可以同時選擇性作用於多個分子靶點,即嚴格意義上的多靶點藥物。單組分藥物在藥物代謝上是較聯合用藥和多組分的藥物有更多優勢的,因其可以克服各組分相互作用產生的不良反應。
由於單靶點藥物隻能調控疾病過程中的一個點,而各種臨床重大疾病通常是多重因素導致的結果,且其病理機製及疾病治療過程非常複雜。因此,單靶點藥物往往會有治療效果不佳、藥物篩選效率不高等缺點。而多靶點藥物可以同時作用於多個病理環節、多種發病機製而產生協同作用效果,從而提高藥物的療效。
藥物靶標通常處於多個信號通路中,具有多重生物學功能,過分激活或抑製某一生物靶標,在幹預一種生物學功能的同時,也可以影響其它正常生物學功能,從而導致毒副作用的發作。多靶點藥物可以更好的平衡多個病理因素間的關係,可以在相對更低的血藥濃度水平,產生單靶點藥物需要高濃度才能產生的生物學效應,且對生物靶標一般具有弱親和力的特點,因而可以減少藥物的不良反應。
生物機體是一個複雜的可自我調節和平衡的係統,長期使用某一單靶點藥物治療疾病,可以誘導機體內部的適應性變化從而激活對抗保護機製或者旁路代償機製等,使疾病對該種藥物不再敏感,造成藥物的耐藥性。而多靶點藥物可以通過同時幹預疾病的主要致病靶標及其代償信號通路或者其保護性信號通路而減少疾病對藥物產生的耐藥性。
多靶點藥物需要協調平衡多方麵的參數使之處於適度區間,如藥效學方麵需要考慮靶標組合的合理性、活性的平衡性和靶標的選擇性;藥動學方麵,要考慮ADME各方麵特性的適當與否;在化學方麵,要考慮其理化性質的合適與否等;靶標組合方麵,它要求選擇疾病病理機製中最關鍵的幾個靶標進行組合,並保證靶標組合的合理性;活性平衡方麵,多靶點藥物對各靶點的作用強度接近而不宜差別太大;靶標選擇方麵,多靶點藥物隻選擇作用於所確定的靶標組合,而不應對其他靶標有多餘的活性,以減小不必要的副作用。
盡管存在很多問題和困難,隨著現代係統生物學、化學生物學以及計算機輔助藥物設計技術等的發展,多靶點藥物的研究也在一步步的拓展。
已上市多靶點藥物的概況
隨著多靶點藥物發現技術的不斷成熟,已經有越來越多的多靶點藥物進入臨床應用,尤其是在癌症、糖尿病、病毒和細菌感染等複雜性疾病中。近年來,FDA先後批準了多個多靶點酪氨酸激酶抑製劑上市,包括2005年獲批的索拉非尼、2006年獲批的達沙替尼、2007年獲批的舒尼替尼和拉帕替尼。另外,多靶點藥物還包括心血管藥物奧馬曲拉、特波格雷、普齊地洛;中樞神經係統藥物拉多替吉、奧氮平、卡巴拉汀等等。
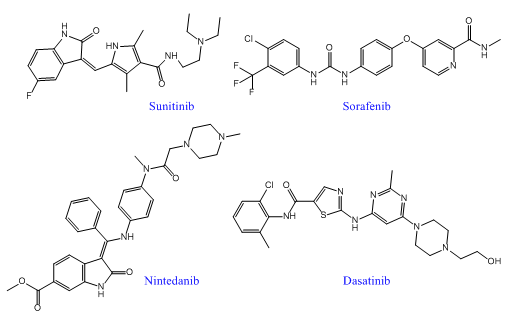
索拉菲尼是第一個用於腫瘤治療的多靶點激酶抑製劑,能抑製RAF-1、B-RAF的絲氨酸/蘇氨酸激酶活性,同時可以抑製VEGFR-2、VEGFR-3、PDGF-β、KTI、FLT-3等多種受體的酪氨酸激酶活性。索拉菲尼具有雙重抗腫瘤作用,既可以阻斷有由RAF/MEK/ERK介導的細胞信號轉導通路,直接抑製腫瘤細胞的增殖,還可以通過作用於VEGF、PDGF-β等受體,抑製新生血管的形成和阻斷腫瘤細胞的營養供應和代謝而達到遏製腫瘤生長的目的。在2005年12月,美國FDA就批準其用於治療晚期腎癌,後2007年11月,美國FDA再次批準其用於無法切除治療的晚期肝癌。該藥在我國分別於2006年和2008年被批準用於晚期腎癌和晚期肝癌的治療。2011~2015連續五年,索拉非尼的年銷售額超過10億美元。

索拉非尼抗靶向細胞增殖和血管生成示意圖
舒尼替尼是一種新型吲哚酮類口服、選擇性多靶點酪氨酸激酶抑製劑,除抑製VEGFR-1、VEGFR-2、VEGFR-3、PDGFR-α、PDGFR-β的活性外,同時也抑製幾種其他相關的酪氨酸激酶的活性,包括c-KIT、FLT-3和RET受體,具有抗血管生成和抗腫瘤活性的雙重作用。美國FDA已經批準其用於晚期腎細胞癌,胃腸間質瘤和晚期胰腺神經內分泌瘤。臨床前期研究表明,舒尼替尼能夠有效抑製人NSCLC異種移植瘤模型的生長。多項臨床研究評估了舒尼替尼在晚期NSCLC治療中的作用,初步顯示其在多線治療後的晚期NSCLC中仍能取得一定的療效,能改善患者生存,且毒性耐受。
阿西替尼是新一代強效的多靶點藥物,其主要的作用靶點為VEGFR-1、VEGFR-2、VEGFR-3、PDGFR-β和c-KIT,是目前對VEGFR信號通路抑製率最強的酪氨酸激酶抑製劑,在多種實體腫瘤中顯示出良好的抗腫瘤活性。FDA已批準用於晚期腎細胞癌的二線治療。在一項阿西替尼單藥治療晚期NSCLC的II期臨床研究中,顯示了其在NSCLC患者中良好的抗腫瘤活性和安全性。
尼達尼布為三重酪氨酸激酶抑製劑,靶點包括VEGF、PDGF和FGF,也可抑製MAPK和AKT的激活。體外研究表明,尼達尼布能持續抑製VEGFR-2達30小時以上。I-II期臨床研究顯示,尼達尼布對第一、二線治療失敗的複發轉移性NSCLC及局部晚期NSCLC有效,部分患者表現為腫瘤縮小,病情穩定。
新多靶點抑製劑的發現
抑製p53-MDM2蛋白結合和組蛋白去乙酰化酶(HDACs)是抗腫瘤藥物開發的重要靶點。受MDM2和HDACs協同作用的啟發,Shipeng He等人發現了第一個MDM2/HDACs雙抑製劑(14d),對MDM2/HDACs這兩個靶點都有很好的活性,且其抗腫瘤機製在癌細胞中得到驗證,為新型抗腫瘤藥物的開發提供了一種很有前途的小分子抑製劑[1]。
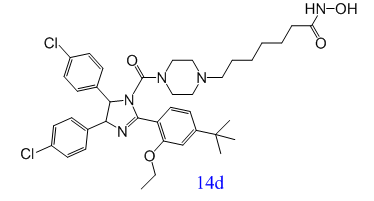
p53是一種轉錄因子,在預防腫瘤發展中扮演著重要角色。大約50%的人類癌症與p53的失活有關[2]。MDM2基因上的rs2279744位點發生突變後,其蛋白產物能夠與 P53 蛋白結合並增強其降解,從而導致 P53 蛋白的抑癌作用減弱。因此,抑製p53-MDM2蛋白質結合成為了一種新興有前途的癌症治療策略[3]。研究發現,單一化合物同時調製多個靶點可能會產生更加卓越的功效以及更少的副作用[4]。組蛋白去乙酰化酶(HDACs),一種表觀遺傳酶,在調節腫瘤抑製基因的表達方麵發揮著至關重要的作用[5]。然而,大多數HDAC抑製劑需要與其他抗腫瘤藥物結合使用,實現協同效應[6]。因此,,Shipeng He等人合理研究設計了首個MDM2/HDAC雙抑製劑(14d)。在A549異種移植模型中,雙抑製劑14d的抗腫瘤效果良好,證明了這種新型多靶向抗腫瘤藥物設計策略的價值。
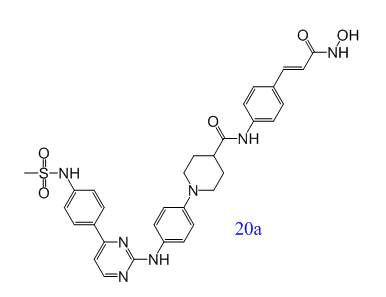
在臨床上,白血病患者常因化療療效有限,且易受侵襲性真菌病原感染。Yahui Huang等人提出了一種新的治療策略:小分子抑製劑可以同時治療白血病和侵襲性真菌感染(IFIs)。新型Janus激酶2(JAK2)和組蛋白去乙酰化酶(HDAC)雙重抑製劑對血液細胞係具有較強的抗增殖活性。其中,化合物20a是一種高度活性和選擇性的JAK2/ HDAC6雙重抑製劑,在幾種急性髓係白血病(AML)模型中顯示出極好的體內抗腫瘤作用,並可與氟康唑協同治療耐藥的白色念珠菌感染[7]。
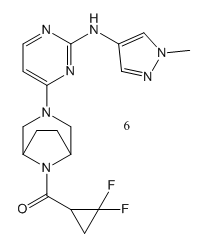
Christel J Menet提到小分子抑製劑6,它具有較好的選擇性和良好的口服生物利用度,並在JAK1和TYK2的雙重抑製給藥方案中取得了臨床益處。在最近的一篇論文中[8],研究結果表明,TYK2 / JAK1抑製劑6有在健康受試者和斑塊性銀屑病患者中有良好的安全性和耐受性,此結論支持抑製劑6在銀屑病及其他炎性疾病治療中值得進一步臨床研究。
從目前藥物研發的情勢來看,創新藥物的研發是迫在眉睫的,而提高藥物研發的綜合水平是我國所麵臨的主要難題。因此,在對已知靶點合理的、最大可能的利用是可實行且回報率高的研究方向,也應多關注於多靶點藥物的設計,從而獲得更多新的多靶點抑製劑,給疾病患者帶來更好的治療效果。
參考文獻:
1,ShipengHe, Guoqiang Dong, Shanchao Wu, Kun Fang, Zhenyuan Miao, Wei Wang and ChunquanSheng.Small Molecules Simultaneously Inhibitingp53-Murine Double Minute 2 (MDM2) Interaction and Histone Deacetylases (HDACs):Discovery of Novel Multitargeting Antitumor Agents.J. Med. Chem. 61, 16, 7245-7260.
2,Hainaut,P. Hollstein, M. P53 and human cancer: the first ten thousand mutations. Adv.Cancer Res. 1999, 77, 81– 137.
3,Wang,S. Zhao, Y. Bernard, D. Aguilar, A. Kumar, S. Targeting the MDM2-p53protein-protein interaction for new cancer therapeutics. Top. Med. Chem. 2012,8, 57– 79.
4,Singh,A. K. Chauhan, S. S. Singh, S. K. Verma, V. V. Singh, A. Arya, R. K.Maheshwari, S. Akhtar, M. S. Sarkar, J. Rangnekar, V. M. Chauhan, P. M. S.Datta, D. Dual targeting of MDM2 with a novel small-molecule inhibitorovercomes TRAIL resistance in cancer. Carcinogenesis 2016, 37, 1027– 1040.
5,Ropero,S. Esteller, M. The role of histone deacetylases (HDACs) in human cancer. Mol.Oncol. 2007, 1, 19– 25.
6,Ong,P. S. Wang, X. Q. Lin, H. S. Chan, S. Y. Ho, P. C. Synergistic effects ofsuberoylanilide hydroxamic acid combined with cispiatin causing cell cyclearrest independent apoptosis in platinum-resistant ovarian cancer cells. Int.J. Oncol. 2012, 40, 1705– 1713.
7,YahuiHuang, Guoqiang Dong, Huanqiu Li, Na Liu, Wannian Zhang and Chunquan Sheng.Discovery of Janus Kinase 2 (JAK2) andHistone Deacetylase (HDAC) Dual Inhibitors as a Novel Strategy for theCombinational Treatment of Leukemia and Invasive Fungal Infections.J. Med. Chem. 2018, 61, 6056−6074.
8,Banfield,C. Scaramozza, M. Zhang, W. Kieras, E. Page, K. M. Fensome, A. Vincent, M.Dowty, M. E. Goteti, K. Winkle, P. J. Peeva, E. The Safety, Tolerability,Pharmacokinetics, and Pharmacodynamics of a TYK2/JAK1 Inhibitor (PF-06700841)in Healthy Subjects and Patients With Plaque Psoriasis. J. Clin. Pharmacol.2018, 58 (4), 434–447.
 相關新聞
相關新聞