
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




癌症是全球頭號疾病之一。伴隨人口老齡化趨勢,在世界範圍內,每年新增確診癌症患者數量近兩千萬,且在逐年增長,以乳腺癌、肺癌、消化道癌症為最。隨著對癌症研究的深入,以及如靶向療法、免疫療法、細胞療法等治療手段的革新,癌症患者的生存期被大大延長,生活質量也得到顯著提升,使得癌症有“慢性病化”的發展趨勢。而伴隨這一趨勢,腫瘤耐藥問題顯得越發重要。
腫瘤的耐藥,是指病人在接受了一段時間的治療,體內的腫瘤組織細胞對原有療法產生耐受,使其治療收益降低歸零,引發疾病進展的現象過程。耐藥性的產生可能是由於病人體內本身存在對原有療法不敏感的腫瘤細胞群體,經治療篩選後得以幸存壯大,造成複發,也可能是在治療過程中,伴隨基因組改變、表觀遺傳學調控、代謝及免疫調控等驅動因素作用,促使腫瘤細胞獲得對藥物療法的耐受能力,引起疾病進展。
耐藥的發生具有普遍性和個性化特點,即對於各類藥物或療法都有可能產生耐藥問題,且造成耐藥發生的機製原理因病人而異。目前經研究,造成腫瘤細胞產生耐藥的機理包括但不限於以下方麵:
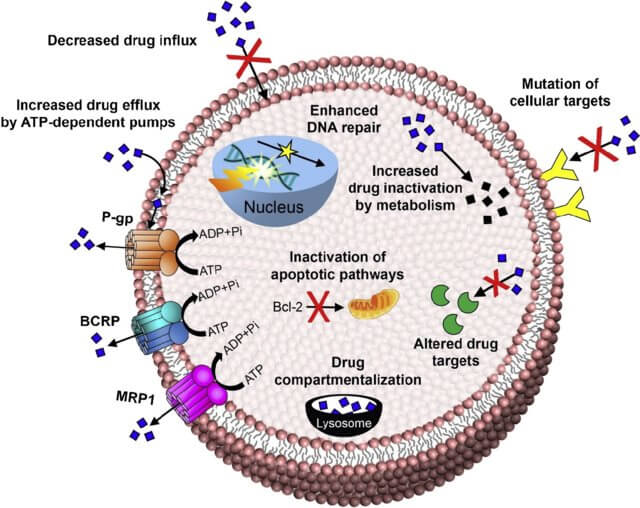
圖1. Mechanisms of Drug Resistance. (Vrinda Gote et al. International Journal of Molecular Sciences 20211)
為了更好地研究了解不同類型藥物耐藥機理,並製定相應的應對策略,開發新型抗癌藥物與療法,耐藥模型的開發構建顯得至關重要。在hjc黄金城,目前我們采用藥物衝擊誘導的方式,針對赫賽汀(Herceptin)、奧希替尼(Osimertinib)、阿貝西利(Abemaciclib)和索托拉西布(Sotorasib)這四款抗癌藥物構建了相應的耐藥模型。
曲妥珠單抗(Trastuzumab),商用名稱:赫賽汀(Herceptin®),由基因泰克(Genentech)公司開發,於1998年獲得FDA審批,用於治療人表皮生長因子受體2陽性(HER2+)的轉移向乳腺癌患者,常與紫杉醇聯用,是第一款被批準的酪氨酸激酶抑製劑,也是第一個成功以生物標誌物為指導的癌症藥物。
奧希替尼(Osimertinib),商用名稱:泰瑞沙(TAGRISSO®),由阿斯利康(AstraZeneca)公司開發,於2015年獲得FDA審批,是第三代表皮生長因子受體酪氨酸激酶抑製劑(EGFR-TKI),用於治療具有EGFRT790M突變特征的局部晚期或轉移性非小細胞肺癌患者。
阿貝西利(Abemaciclib),商用名稱:唯擇(Verzenio®),由禮來(Eli Lilly)公司開發,於2017年獲得FDA審批,作為新型靶向CDK4/6抑製劑,用於治療激素受體陽性(HR+)、人表皮生長因子受體2陰性(HER2-)的局部晚期或轉移型乳腺癌患者。
索托拉西布(Sotorasib,AMG510),商用名稱:LUMAKRAS®,由安進(Amgen)公司開發,於2021年獲得FDA審批,作為第一款靶向KRASG12C突變的RAS GTPase抑製劑,用於治療高階或轉移性非小細胞肺癌患者,而此前KRASG12C一直被認為是無法成藥的靶點。2023年12月,因在PFS關鍵指標上,未獲得體現其相對於化療單臂的顯著性收益結果,FDA拒絕完全批準LUMAKRAS®用於治療既往至少接受一次全身治療的KRASG12C突變非小細胞肺癌患者。
構建策略上,我們采用對體外細胞給予藥物暴露衝擊誘導的方式,來模擬臨床病人接受治療後的獲得性耐藥產生過程。
具體而言,我們結合了脈衝式(Pulsed)與連續式(Continuous)給藥衝擊方式:脈衝式給藥采用單次4~6小時高濃度藥物暴露,模擬臨床病人接受治療時的藥物代謝與暴露情況;接受脈衝式藥物衝擊後,細胞將繼續在低濃度的藥物暴露條件下生長,以維持其產生的耐藥性不丟失。經過多輪藥物衝擊後獲得的耐藥細胞模型,將與原始的野生型細胞進行對比,以其體外藥敏檢測的IC50值的比值,即RF值,為判斷標準,來衡量耐藥性的強弱,並以此作為耐藥模型構建成功與否的評價標準。參考McDermott et al.2等同行工作,我們將RF值>5作為判定耐藥模型構建成功的標準。
在成功構建體外耐藥細胞係後,我們進一步在免疫缺陷小鼠身上構建耐藥細胞係的移植瘤模型,研究評價成瘤情況以及其對受試藥物的耐受表現。
在赫賽汀耐藥模型構建方麵,我們選擇了具有ER+/HER2+特征的BT-474人乳腺癌細胞係,通過藥物衝擊誘導的方式,成功構建了赫賽汀的耐藥模型。體外藥敏檢測結果顯示,原始野生型IC50值為0.693 μg/mL,耐藥型IC50值提高到174.5 μg/mL,RF值為251.8(圖2a)。在體內藥效評價實驗中,野生型移植瘤模型的腫瘤抑製率(%TGI)值為85.11,耐藥型移植瘤的腫瘤抑製率降低為52.57(圖2b)。
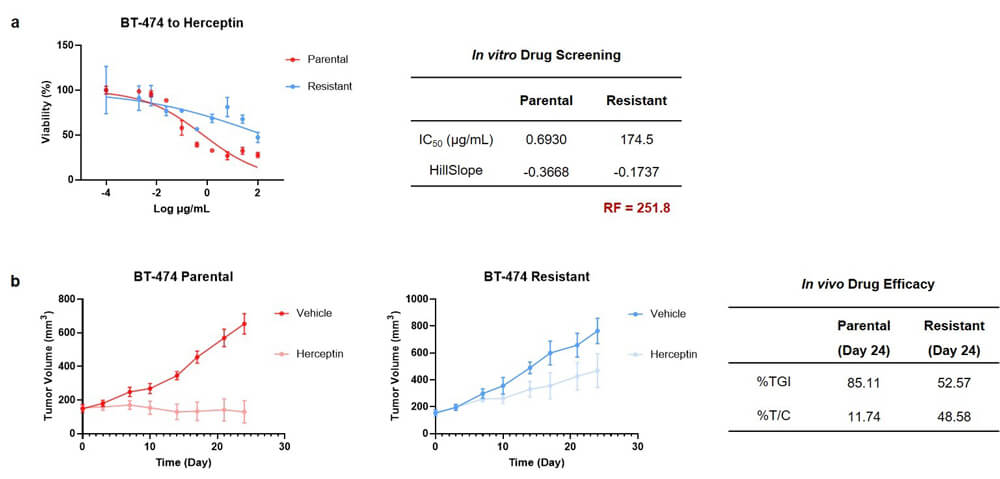
圖2.BT-474_赫賽汀耐藥模型實驗結果: a) 體外藥敏檢測實驗結果;b) 體內成瘤與藥效實驗結果.
在奧希替尼耐藥模型構建方麵,我們選擇了具有EGFRL858R/T790M突變特征的NCI-H1975人非小細胞肺癌細胞係,通過藥物衝擊誘導的方式,成功構建了奧希替尼的耐藥模型。體外藥敏檢測結果顯示,原始野生型IC50值為65.9 nM,耐藥型IC50值提高到10940 nM,RF值為166(圖3a)。在體內藥效評價實驗中,野生型移植瘤模型的腫瘤抑製率(%TGI)值為93.72,耐藥型移植瘤的腫瘤抑製率降低為70.05(圖3b)。
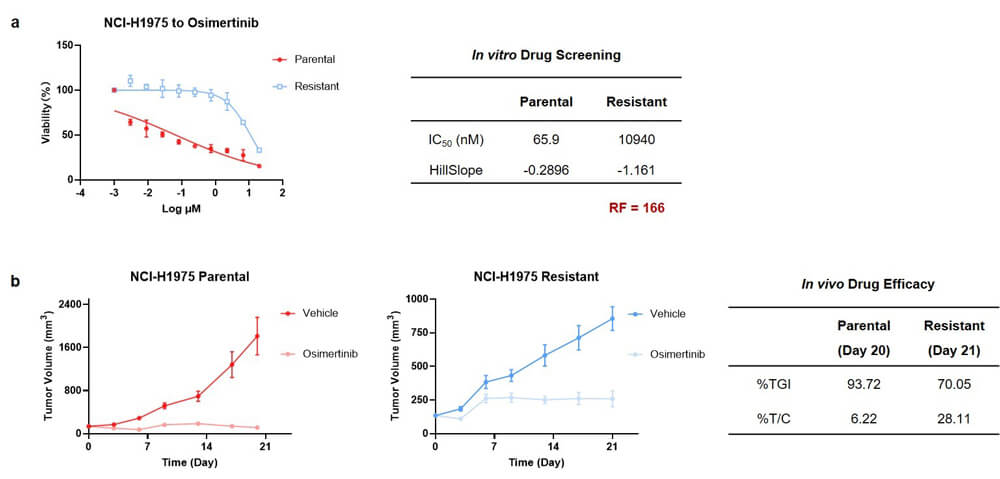
圖3. NCI-H1975_奧希替尼耐藥模型實驗結果: a) 體外藥敏檢測實驗結果;b) 體內成瘤與藥效實驗結果.
在阿貝西利耐藥模型構建方麵,我們選擇了具有HER2-特征的MCF-7人乳腺癌細胞係,通過藥物衝擊誘導的方式,成功構建了阿貝西利的耐藥細胞係模型。體外藥敏檢測結果顯示,原始野生型IC50值為0.2536 μM,耐藥型IC50值提高到1.649 μM,RF值為6.5(圖4)。MCF-7的體內移植瘤模型在成瘤方麵上表現不佳,因而體內數據未做展示。
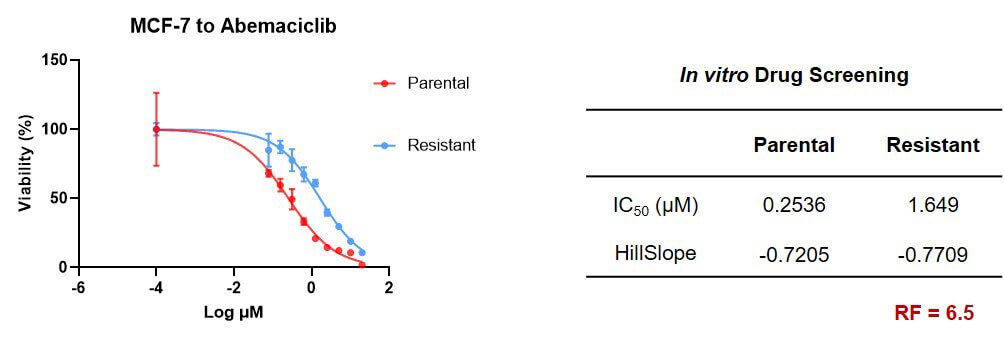
圖4. MCF-7_阿貝西利耐藥細胞係體外藥敏檢測實驗結果.
在索托拉西布耐藥模型構建方麵,我們選擇了具有KRAS G12C突變特征的NCI-H358人非小細胞肺癌細胞係,通過藥物衝擊誘導的方式,成功構建了索托拉西布的耐藥細胞係模型。體外藥敏檢測結果顯示,原始野生型IC50值為19.99 nM,耐藥型IC50值提高到350.2 nM,RF值為17.52(圖5a)。NCI-H358體內耐藥模型構建與驗證實驗尚在進行中。
另外,我們在Calu1小鼠細胞係移植瘤模型上,通過連續藥物暴露衝擊誘導的方式,構建了索托拉西布的Calu1移植瘤耐藥模型,其耐藥表現如圖5b所示。
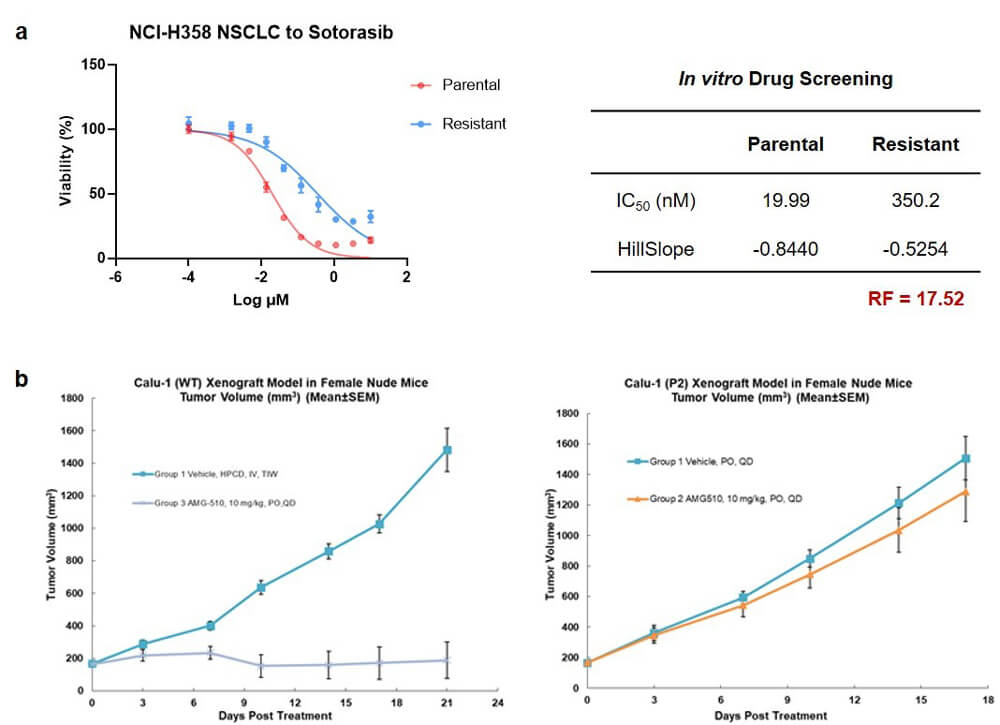
圖5.索托拉西布耐藥模型實驗結果: a) NCI-H358_索托拉西布耐藥細胞係體外藥敏檢測實驗結果;b) Calu1耐藥移植瘤模型體內藥效實驗結果.
1. Vrinda Gote, et al. Drug Resistance in Metastatic Breast Cancer: Tumor Targeted Nanomedicine to the Rescue. Int J Mol Sci. 2021 Apr 28;22(9):4673. doi: 10.3390/ijms22094673.
2. Martina McDermott, et al. In vitro Development of Chemotherapy and Targeted Therapy Drug-Resistant Cancer Cell Lines: A Practical Guide with Case Studies. Front Oncol. 2014 Mar 6:4:40. doi: 10.3389/fonc.2014.00
 相關新聞
相關新聞