
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




2015年08月份美國FDA共審批通過5種新藥,1類新分子實體藥物2個; 3類新劑型藥物1個; 5類新規格或新生廠商藥物1個;7類已上市但未經NDA批準的藥品1個。
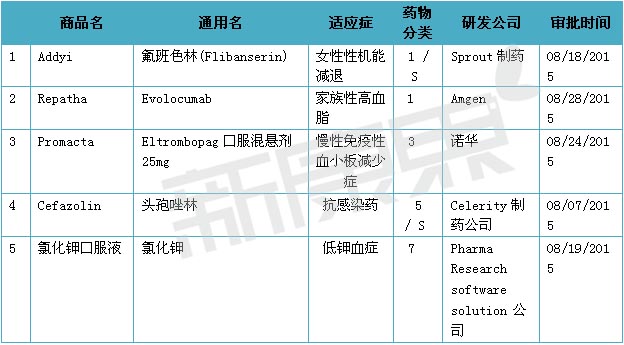
一、女性性機能減退新分子實體藥物Addyi(氟班色林)
2015年08月18日,美國FDA批準了Sprout製藥公司的女性性機能減退新分子實體藥物Addyi(氟班色林)上市。Addyi為口服片,,每片含氟班色林100mg,推薦的使用劑量為每日100mg。特別需要注意的是由於女性服用Addyi後會出現低血壓、暈厥、意外受傷、中樞神經係統紊亂的不良反應,因此建議患者在就寢時間服用Addyi。同時由於Addyi與酒精相互作用會增加患者低血壓和暈厥的風險,因此患者在服用Addyi時禁止飲酒。
二、降血脂新藥Repatha (Evolocumab)
2015年08月28日,美國FDA批準了Amgen公司的降血脂新單克隆抗體藥物Repatha (Evolocumab)上市。Repatha為PCSK9抑製劑,PCSK9為前蛋白轉化酶枯草溶菌素9蛋白,該蛋白可降低肝髒從血液中清除低密度脂蛋白膽固醇(LDL-C)的能力,而LDL-C被公認為心血管疾病的主要風險因子。Repatha用於原發性高血壓患者和純合子家族性高膽固醇血症。在2015年07月24日,美國FDA批準了賽諾菲安萬特的降血脂新單克隆抗體藥物Praluent(alirocumab)上市,Praluent同樣為PCSK9抑製劑類降脂藥。
Repatha為皮下注射劑,規格為140 mg/mL,可在腹部、大腿及上臂區域皮下注射。
美國FDA審批新藥主要是根據藥物化學類型和治療潛能來進行分類的。新藥按化學類型主要分為:1類新分子實體化合物(NME),創新性最強。指在美國從未作為藥品批準或銷售的活性成分,可以是單一成分,也可以是立體異構混合物中的一部分;2類新的衍生物。從已上市的活性成分(即所謂“專利”藥)化學衍生而來,即已在美國上市的活性成分的酯、鹽或其它非共價鍵衍生物,或者是去修飾基團的母體化合物未在美國批準上市的;3類新劑型。含有已上市活性成分的新劑型或新處方,其適應症可以與上市產品相同,也可以不同;4類新組合物。含有兩種或兩種以上已上市的活性成分的品種,上市產品中尚無這種組合;5類藥物新規格或新生產商;6類新適應症。由同一家公司或其他公司在美國批準或上市的具有新用途的複製品;7類已上市但未經NDA批準的藥品。適應症已與上市產品相同,也可不同;8類變為非處方藥;10類適應症不同的新的新藥申請。
 相關新聞
相關新聞