溶出度試驗的重要性已毋庸置疑,該實驗在口服固體製劑品質評價和仿製藥研發中愈來愈發揮出舉足輕重的作用,而尋找到客觀存在、並確定出最能體現原研製劑內在優良品質、具有區分力的溶出曲線才是本實驗的重中之重,本文將就此展開論述。
溶出度試驗在評價口服固體製劑內在品質和仿製藥研發中愈來愈發揮出舉足輕重的作用,尤“在多種pH值溶出介質中溶出曲線的測定和比對”更是成為“剖析”和“肢解”固體製劑內在品質一種擘肌分理、抽絲剝繭的重要手段;成為口服固體製劑內在品質呈現於外在的一種“表象”、“映射”和“載體”。現今,人們愈發關注溶出度試驗的區分力,即什麽樣的溶出曲線最能代表產品內在品質、最適合評估仿製製劑處方篩選與工藝開發、最能在仿製製劑與原研製劑體外溶出行為比較時體現出差異性,最具有體內外相關性,且最適合製訂入質量標準等問題,本文將就此展開討論。
既有質量標準的局限性
國內質量標準
由於之前的多年,國內對溶出度試驗未給予高度重視和科學認知,無論是在新藥審評還是在藥檢機構後期製訂國家標準時,出發點皆是為了讓既有產品合格來擬定試驗參數,故目前很多國內質量標準均擬定得較為寬鬆(如高轉速、加入高濃度表麵活性劑甚至有機溶劑、采用溶解度大的溶出介質等),無區分力,借鑒性不強。
國外質量標準與進口質量標準
由於溶出度試驗的重要性,故在我們所能查閱獲取的質量標準中,很多品種的溶出度試驗均具有一定的“隱晦性”。當我們獲取數批原研製劑、按照質量標準試驗條件檢測時,結果往往都是較為快速釋放情形(最多30min就已達85%)。深度剖析測定原研製劑後發現,實驗條件很多不具區分力,即便美國FDA公布的溶出度數據庫中有的品種也如此。在FDA/CDER屬下的仿製藥辦公室於2012年下半年推出的、“質量源於設計”理念應用於仿製藥研發——速釋與緩控釋製劑2個研發模板中就列舉了以上條件不具備區分力的研發案例。所以,若我們盲目迷信以上這些標準,秉承“照本宣科的拿來主義”,就會在仿製藥開發和品質評價時誤入歧途,甚至劍走偏鋒,造成錯誤判斷。
但我們仍要客觀認知到:國外這些質量標準的“韜光養晦”是被允許的,因為本行業為高科技、高利潤、高附加值產業,原研企業出於自身利益考慮,將最具區分力的內控方法試驗條件予以保密,對外公開了較為寬鬆的貨架期質量標準。這種行為無可厚非。重要的是:作為追趕者,我們的工作一定要基於對參比製劑的深度剖析和解讀,秉承“知己知彼、百戰不殆”的思想,獲取數批參比製劑、檢測關鍵屬性,當發現既有質量標準不科學時決不能抱殘守缺、以訛傳訛,應予以客觀合理的更改完善。所以,國家藥品審評中心早在2003年就提出了“仿產品不是仿標準”的指導思想,其中的標準涵蓋所有國內外既有質量標準。
何種溶出曲線具有區分力
本文將分別從最具開發難度、最具“製劑含金量”的五大類產品進行闡述:
pH值依賴性藥物製劑
在進行了“pH值-溶解度”曲線測定後(至少8個點),便可從趨勢中得知本品是否為pH值依賴性製劑。若為本類型,通常會在50rpm條件下,出現如下情形:溶解度高的介質中15min達85%的快速釋放和在溶解度低的介質中120min都達不到85%的慢速釋放。這兩種情形均非內在品質呈現於外的最佳體現,因過於快速和過於慢速均不具備區分力。
此時,應對溶解度急劇變化的pH值段予以細分(±0.5),找到45~60min達85%的pH值介質和90~120min達85%的pH值介質,且溶出曲線應無拐點和突釋,這樣的兩條曲線被認為是既不慢、又不快,最具區分力。原因如下:
很多藥典的溶出度試驗默認45min、限度70%就是基於這種考慮:>70%+15%(通常的允許落差)>85%,此時的曲線被認為是具有代表性的溶出行為。同時,對於速釋製劑而言,藥物在人體胃內排空時間最長不超過120min,且超過該時間點也被認為不適用於日常企業的檢測和品質監督,因此第二條特征曲線被限定在120min內達到85%,這也是目前既有質量標準中幾無120min後取樣時間點的原因。此處需強調的是,針對釋放慢的介質,無需放寬試驗參數,最終溶出量未達85%仍可進行仿製製劑與原研製劑的曲線比較,因已有三條曲線達85%、且其中還含有區分力介質,故該介質無需再深入研究。
難溶性口服固體製劑
如在50rpm條件下任何一個介質在120min均達不到85%,則建議放寬溶出度試驗參數,仍是應盡可能采用低轉速和低濃度表麵活性劑,仍是以45~120min達到85%的條件確定為具有分辨力的溶出行為。
治療窗狹窄藥物製劑
鑒於臨床使用的安全性,此類藥物的體內/體外釋放行為均極為關鍵,故質量標準中常擬定兩點法:通常第一時間點釋放量不得過某限度以防止突釋,第二點釋放量不得少於某限度以保證全部釋放。如卡馬西平片,《日本溶出曲線數據庫》擬定5min不得過60%和30min不得少於70%;美國藥典擬定10min釋放量應為30~50%,45min時不得少於75%。兩點法的規定即限定了溶出曲線的具體行為,又可有效防止處方中加入大量表麵活性劑或增溶劑的“投機取巧”作法,值得借鑒。
緩控釋製劑
一般設定50rpm、並以每天服用次數設定取樣時間點,如每天1次應測定至24h,並在該時間內曲線應呈緩慢上升狀,且無突釋和拐點。
為更全麵地進行仿製製劑的開發與品質評價,還應分別比較不同轉速下與原研製劑溶出曲線的一致性,如50rpm(呈現24h釋放情形)、100rpm(呈現12h釋放情形)、200rpm(呈現8h釋放情形);且有時在製訂質量標準時,為提高質檢科檢測效率,擬定200rpm、8h釋放控製的質量標準也是可以的。如阿斯利康製藥有限公司(江蘇無錫)出品的非洛地平緩釋片,用法用量為一天一片,但質量標準卻擬定槳板法/200rpm、7h的取樣測定就是基於該考慮。
腸溶製劑
針對該類製劑在體內吸收的特性,體外溶出曲線的研究和比較應進行多方麵、多層次、多角度,具體如下:
(1)100rpm pH1.2介質(2小時) 釋放量不得過10.0%。
采用100rpm是為防止在身體機能強壯者體內的釋放量符合釋放要求。
(2)100rpm pH4.5介質(2小時) 釋放量不得過10.0%。
采用pH4.5介質是為防止藥物在中老年人群胃內的釋放量符合釋放要求。該部分人群因年齡增長,胃酸分泌逐漸缺乏,胃內環境pH值呈上升狀態。所以,英國藥典自2006年版起,奧美拉唑腸溶膠囊和腸溶片如此要求便是出於該考慮。
(3)50rpm pH6.0介質 注意延遲釋放
腸溶製劑在十二指腸處的釋放極為重要,故應研究該pH值;且原研製劑往往呈現延遲釋放行為,此時仿製製劑也應具有該現象,否則在進行體內生物等效性試驗研究時,Tmax往往不一致,導致試驗失敗,臨床療效出現不一致。
同時,還建議進行溶出介質稀釋5倍後的比較評價,因腸溶製劑在體內的吸收易受體內離子強度的影響,故體外應考慮低濃度溶出介質的檢測研究。
(4)100rpm pH6.0介質 注意延遲釋放
考慮到人體內十二指腸蠕動的多重性,並為防止藥物在體內發生“劑量傾瀉”行為,故應進行該情形的研究。
(5)50rpm pH6.8介質 注意延遲釋放
注釋同pH6.0介質。
(6)50rpm pH1.2介質(2小時)+ pH6.8介質
為模擬藥物在人體內的實際情形還應進行混合介質的研究。筆者曾接觸過數個生物等效性(BE)試驗失敗案例,折回後再進行混合介質比較才發現仿製製劑與參比製劑體外溶出行為的顯著性差異,隻好再度完善仿製製劑處方與工藝。這充分揭示了體外溶出度研究比較的全麵性至關重要。
(7)50rpm pH4.5介質(2小時)+ pH6.8介質
注釋同pH1.2介質。
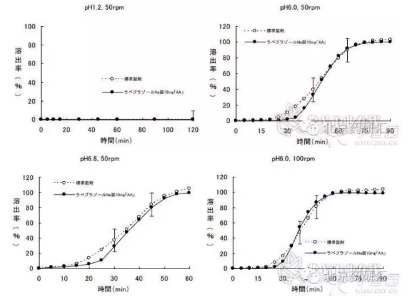
圖1. 日本一腸溶製劑仿製藥研發體外溶出曲線比對實例。(左上:槳板法50rpm、pH1.2介質;右上:槳板法50rpm、pH6.0介質;左下:槳板法50rpm、pH6.8介質;右下:槳板法100rpm、pH6.0介質。)
討論與總結
目前溶出度試驗的重要性已深入人心,且國家藥品審評中心也已於2011年4月針對仿製製劑的研發出台了強製性要求。但在具體實施時,很多同仁依舊秉承照搬照抄、甚至抱殘守缺既有質量標準的思想;或是為了讓自我既有產品合格的出發點,采用了寬鬆、沒有區分力的試驗條件,未能從原研製劑入手來深度剖析獲取其關鍵特性、獲取具有區分力的溶出度試驗條件和溶出行為。
文獻從製劑各要素角度闡述了溶出度檢查法的分辨力。本文在總結大量實際案例和對多個品種原研製劑深度剖析解讀的基礎上,從分析角度直觀給出了何種溶出曲線最具區分力的觀點。隻要把握好以上這些具有區分力的溶出曲線/行為,才能在仿製製劑處方工藝開發、仿製藥品質評價、質量標準的製訂等諸多方麵發揮出事半功倍、畫龍點睛之效,期望能為眾人工作起到拋磚引玉的作用。















 相關新聞
相關新聞