
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




腫瘤細胞遷移是惡性腫瘤最重要的特征之一,瘤細胞由其原發部位侵入血管或淋巴管或體腔,部分細胞被血液、淋巴液帶到另一部位或器官,在該處繁殖生長,形成與原發瘤同樣類型的腫瘤,這一過程即為腫瘤的侵襲和轉移。
目前檢測腫瘤細胞遷移的方法主要有細胞劃痕實驗及Trans-Well小室遷移實驗,傳統的細胞劃痕實驗需要連續觀測以評估藥物對細胞遷移的作用,因此,其麵臨的最大的問題是不能保證每次觀察的都是同一位點,對結果不能進行定量分析,也不能區分劃痕內的細胞是遷移還是增殖的而來的。而Trans-Well小室遷移實驗雖能定量檢測細胞遷移的數量,但不能直觀觀測細胞遷移過程,也不能將遷移和增殖細胞區分出來,而且其價格昂貴,不適合抗腫瘤細胞遷移藥物的大規模篩選。
細胞遷移與侵襲實驗將Transwell小室放入培養板中,小室內稱上室,培養板內稱下室,上下層培養液以聚碳酸酯膜相隔,將研究的細胞種在上室內,由於聚碳酸酯膜有通透性,下層培養液中的成分可以影響到上室內的細胞,應用不同孔徑和經過不同處理的聚碳酸酯膜,就可以進行共培養、細胞趨化、細胞遷移、細胞侵襲等多種方麵的研究。
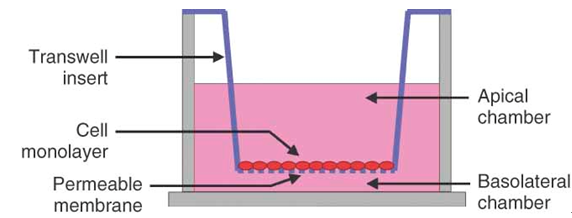
Transwell小室放入培養板中,小室內稱上室,培養板內稱下室,上室內盛裝上層培養液,下室內盛裝下層培養液,上下層培養液以聚碳酸酯膜相隔。我們將細胞種在上室內,由於聚碳酸酯膜有通透性,下層培養液中的成分可以影響到上室內的細胞,從而可以研究下層培養液中的成分對細胞生長、運動等的影響。應用不同孔徑和經過不同處理的聚碳酸酯膜,就可以進行共培養、細胞趨化、細胞遷移、細胞侵襲等多種方麵的研究。
※共培養實驗:在選擇膜孔徑的時候需要考慮實驗的目的和實驗細胞的大小,當膜孔徑小於3μm的時候,細胞不會遷徙通過,所以如果不涉及研究細胞運動能力,應選擇3μm以下的,通常是0.4μm或者3μm,例如在共培養體係研究細胞B分泌或代謝產物對細胞A的影響,就可以把A種在上室裏,將B種在下室。
※趨化性實驗:可用5.0、8.0、12.0µm膜,上室細胞可穿過聚碳酸酯膜進入下室,計數進入下室的細胞量可反映下室成分對上室細胞的趨化能力。
i.細胞B對細胞A的趨化作用:將細胞A種於上室,細胞B種於下室,可以研究細胞B分泌或代謝產生的物質對細胞A的趨化作用。
ii.趨化因子對細胞的趨化作用:將細胞種於上室,下室加入某種趨化因子,可研究該趨化因子對細胞的趨化作用。
常用8.0μm(8μm孔徑的膜為文獻中用來做侵襲和轉移實驗最常用的規格,本次訂購的是Corning公司的用來做transwell migration的8μm孔徑的24孔板transwell insert以及用來做transwell invasion的BD公司的8μm的24孔板鋪膠transwell chamber)、12.0µm膜,上室種腫瘤細胞,下室加入FBS或某些特定的趨化因子,腫瘤細胞會向營養成分高的下室跑,計數進入下室的細胞量可反映腫瘤細胞的遷移能力。FBS是最常用的趨化因子,本實驗也準備選用FBS作為遷徙和侵襲實驗的趨化因子。
常用8.0、12.0µm膜,原理與腫瘤細胞遷移實驗類似,上室種腫瘤細胞,下室加入FBS或某些特定的趨化因子,腫瘤細胞會向營養成分高的下室跑,但與腫瘤細胞遷移實驗不同的是,聚碳酸酯膜上室側鋪上一層基質膠,用以模仿體內細胞外基質,細胞欲進入下室,先要分泌基質金屬蛋白酶(MMPs)將基質膠降解,方可通過聚碳酸酯膜。計數進入下室的細胞量可反映腫瘤細胞的侵襲能力。
1、Transwell 小室的製備
※Corning公司的8μm孔徑無膠24孔板transwell insert
i. 預平衡:在24孔板中和transwell小室中加入培養液,在37℃的培養箱裏平衡一個小時或者過夜,這樣能夠增強細胞的粘附作用。
ii. 正式使用:24孔板中加入含5-10%FBS的培養液0.6ml,將transwell inset 放入板中(用鑷子),在transwell insert中加入無血清的培液0.1ml。(操作手冊提示:實驗過程中,培液的高度需要定時的去觀察,當需要維持要求高度的時候可以補加新鮮培液)
※BD公司的8μm孔徑鋪有基層膠的24孔板transwell chamber
i.再水化:從-20℃中取出並打開包裝置於室溫,往transwell小室以及24孔板中各加入37℃的培液0.5ml,然後置於37℃,5%CO2培養箱中孵育2h使得基質膠再水化。
ii.再水化後:小心的將培液吸走,注意別觸到基質膠。
2、製備細胞懸液
i. 製備細胞懸液前可先讓細胞撤血清饑餓12-24h,進一步去除血清的影響。但這一步並不是必須的。
ii. 消化細胞,終止消化後離心棄去培養液,用PBS洗1-2遍,用含BSA的無血清培養基重懸。調整細胞密度至1-5×105個/ml,具體的細胞密度需進行預實驗,migration與invasion的細胞密度也有所不同(細胞量過多,穿過膜的細胞會過多過快,如果最後用計數法統計結果的話將難以計數;而過少的話,可能還沒到檢測的時間點,所有的細胞都已穿過,因此最少也要保證在收樣的時候,上室內還要有一定量的細胞存在。)
3、接種細胞
i. 取細胞懸液體積V1加入Transwell小室,不同規格Transwell小室對細胞懸液量有不同要求,參考說明書。Corning公司24孔板transwell insert中加入的體積為0.1ml,BD公司的鋪膠24孔板transwell insert中加入的體積為0.5ml。
ii.24孔板下室一般加入體積V2含FBS的培養基(FBS濃度需進行預實驗),不同的培養板加的量有不同要求,具體請參考說明書。特別注意:下層培養液和小室間常會有氣泡產生,一旦產生氣泡,下層培養液的趨化作用就減弱甚至消失了,在種板的時候要特別留心,一旦出現氣泡,要將小室提起,去除氣泡,再將小室放進培養板。
iii. 常規培養12-48h,時間點的選擇需考慮到細胞侵襲能力、趨化因素和細胞數目等。
iv. 注意事項
l 需要考慮轉oligo之後與NC相比,會不會對細胞的增值以及凋亡產生影響,如果轉oligo後能抑製細胞增值以及促進細胞凋亡的話,那需要關注MDA-231侵襲能力的下降是因為細胞數目的減少還是因為確實轉移和侵襲能力下調了(是否需要加一個什麽都不轉的對照組?)
l 時間過長不可以,同樣,過短也不行,因為細胞內會有一定量的MMPs儲存,短時間內可能侵襲能力不會有太大改變。同時從oligo的轉入到進而發揮作用,影響MMPs表達,到最後釋放到培養基中,還需要一個過程,所以時間太短效應不明顯,但是時間的延長不能影響到細胞增值的改變。
l 細胞在小室內的形態有可能不是正常培養貼壁的形態,而是圓形的,仍是懸浮時的形態,不過會聚集成團,屬正常現象(別人的經驗,注意觀察)
l 在培養過程中,膜下會逐漸有少量小氣泡產生,這是正常現象,可不予處理,但如果出現了大氣泡,一定要去除,否則嚴重影響實驗結果。最好接種細胞後1-2h把培養板從培養箱裏拿出來看看,確信沒有大氣泡產生。
4、結果統計
※去除基層膠和未侵襲出膠的細胞(參照BD公司的操作手冊)
i. 去除transwell小室中的培養液
ii. 用幹淨的濕棉簽,輕柔地但是均一用力擦除小室膜上表麵的基質膠以及未侵襲出膠的細胞(invasion),或者擦除未轉移跨膜的細胞(migration)。
iii. 用第二根濕棉簽重複一次
注意:整個過程應該盡量快的完成,以免膜下表麵的細胞幹掉。
※細胞固定與染色
i. 結晶紫染色法:先固定後染色,各文獻中固定方法不一,大致有以下幾種:100%甲醇固定10min、4%的多聚甲醛固定15min或者100%乙醇固定10min。固定完之後用0.1%的結晶紫染色染30min。該方法為文獻中最常用的方法(訂購結晶紫試劑)
ii. 瑞氏染色法:同樣是先固定,可以選用100%甲醇固定10min,隨後用瑞氏染液即A液一倍體積混合B液2倍體積後染色相應時間。該染色方法文獻中使用較少,所以染色時間有待摸索,根據小趙師兄之前的經驗應該在20分鍾以上。
iii. 使用BD公司的Diff-Quik staining kit:這個方法文獻中也有使用,操作步驟嚴格按照BD公司的使用手冊,但是須購買BD公司kit,較貴。
※ 細胞計數
i.用鋒利的刀片將膜從小室中分離下來,具體是先將刀尖插入膜與小室的邊緣處形成一個小口,然後讓小室逆著刀口的方向旋轉,這樣膜就被分離開來,當剩下少許連接的時候用鑷子以盡量少的接觸麵積夾在膜上,最終將剩餘的膜分離。
ii.事先準備好一塊載玻片,在上麵滴一滴油,將分割下來的膜有細胞麵朝上用鑷子置於油上,隨後再在膜上滴加一滴油,蓋好蓋玻片後,置於顯微鏡下拍照計數。
注:細胞計數可以用顯微照相裝置拍下幾個具有代表性的視野然後進行計數,也可以直接在顯微鏡下計數,前者較優。
以上是關於細胞遷移實驗服務、細胞遷移和侵襲實驗的內容,內容來源於hjc黄金城官網。
 相關新聞
相關新聞