兒童用藥審評審批加快立項切入點
2016-06-24
|
訪問量:{"id":1,"bid":"28.43","change":"-0.96","shishi":"27.47","jinkai":"28.15","change_rate":"-3.38","change_rate_html":"(-3.38%)","high":"28.73","low":"27.46","volumn":"2193321","turnover":"6119","turnover_num":0.61,"time":1721806620,"time_date":"PM 15:37\u20222024-07-24"}
防治兒童疾病且具有明顯臨床優勢的藥品注冊申請可以加快審評審批。根據2016年《關於臨床急需兒童用藥申請優先審評審批品種評定基本原則》,臨床急需兒童專用藥品有3種可優先審評審批:一是新增用於兒童人群品種,即創新型新藥或新3類仿製藥;二是改劑型或新增規格品種;三是市場短缺的仿製品種。
其中,創新型新藥或新3類仿製藥必須是針對嚴重威脅兒童生命或者影響兒童生長發育,且目前無有效治療藥物或治療手段的疾病,或相比現有治療藥物具有明顯治療優勢的新藥。改劑型或新增規格品種必須在國內現行藥品說明書中包含有確定的“兒童用法用量”且現有劑型或規格均不適用於兒童,而新增劑型或規格適合於兒童。改劑型或新增規格品種或市場短缺的仿製品種,若申報廠家的數目為多家申請的,按照申請先後排隊順序,對排第一位的優先審評,若經審評不符合要求,則取消優先資格,後麵的同品種申請可按序增補替代。
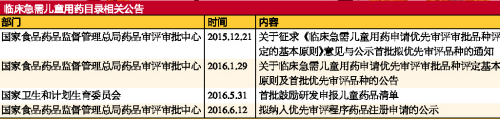
截至2016年6月12日,CFDA藥品審評審批中心(CDE)網站共公布了2次擬優先審評品種名單,1次正式名單;國家衛計委公布了1次首批鼓勵研發申報兒童藥品清單。
優先審評品種:
改劑型是主要的研發方向?
首批擬優先審評品種共公示了6個製劑產品,對應10個批文,最終正式名單公布時,僅剩下4個製劑產品,對應5個批文。被刷下的原因主要在於兩點:1)現有劑型或規格已適用於兒童;2)改劑型或新增規格品種或市場短缺的仿製品種的申報廠家的數目為多家申請的,按照申請先後排隊順序,並非排第一位。
首批優先審評品種正式名單的產品中:氯法拉濱注射液屬於創新型新藥或新3類仿製藥,枸櫞酸咖啡因注射液屬於市場短缺的仿製品種,鹽酸普萘洛爾口服溶液和兒童用法羅培南鈉幹糖漿都屬於改劑型品種。這4個產品的適應症都是針對兒童罕見病,並且有專門針對兒童的用法用量。
已經在申報生產階段的有氯法拉濱注射液和枸櫞酸咖啡因注射液。從目前藥品注冊審評審批加快的進度而言,兩個產品能否獲批預計將在今年內知曉。氯法拉濱注射液目前有2家申報生產,2014年齊魯藥業申報生產的氯法拉濱注射液已經公告撤回,貝達藥業的也在臨床自查核查名單之內。枸櫞酸咖啡因注射液在歐美已廣泛應用於治療可能致殘和致命的早產兒呼吸暫停症10多年,CDE在2012年曾對枸櫞酸咖啡因注射液采用豁免注冊臨床的審評策略,但是在上市後需開展應用該品治療早產兒呼吸暫停的開放性的臨床試驗,建議病例數不少於200例。從CDE網站數據可知,意大利凱西製藥公司的Ⅳ期已招募完成,試驗仍在進行中。
申報臨床的鹽酸普萘洛爾口服溶液和兒童用法羅培南鈉幹糖漿的第一家申報廠家都已獲批臨床。鹽酸普萘洛爾口服溶液適應症為嬰幼兒的淺表型血管瘤、深部血管瘤、混合型血管瘤、節段型血管瘤、孤立型血管瘤,不同於普萘洛爾的其它口服製劑,預計仍需要做臨床試驗,但暫無相關試驗開展的進度數據。
6月12日公布的新一批擬納入優先審評的兒童藥中,麥格司他膠囊屬於創新型新藥或新3類仿製藥,鹽酸右美托咪定鼻噴劑和鹽酸托莫西汀口服溶液都屬於改劑型品種。申報生產的麥格司他膠囊也是臨床自查核查名單的一員。
適應症方麵,無論是首批優先審評兒童藥名單還是新一批擬納入優先審評的兒童藥名單,罕見病、腫瘤、神經係統、呼吸係統等都是主要的覆蓋範圍。
鼓勵研發申報兒童藥品清單:
兒童安全性是最大考量
從劑型來看,國家衛計委所公布的“首批鼓勵研發申報兒童藥品清單”主要是口服溶液劑和注射劑,這兩類劑型往往是免臨床的。
一直以來,國家對於兒童用藥都是鼓勵的,鼓勵生產企業積極研發仿製藥的兒童專用規格和劑型;鼓勵立題依據充分且具有臨床試驗數據支持的兒童專用規格和劑型的申請優先審評;對兒童用藥在招標、定價、醫保等方麵采取綜合鼓勵措施。
由於兒童用藥臨床試驗難以開展、市場規模小,企業並不願投入成本進一步研發。於是,在現有的已上市產品基礎上改劑型增加規格,相對而言投入成本較低,是國家扶持的一條路,也是企業相對較為願意往前推進的一條路。
根據鹹達數據V3.2,“首批鼓勵研發申報兒童藥品清單”的23個通用名已在我國上市。地高辛、腎上腺素、碳酸氫鈉、長春堿(長春花堿)和胰高血糖素鼓勵的劑型已在我國上市,但清單提倡的規格暫無在我國上市,這意味著這5個藥品屬於增加規格項目,而且這5個藥品鼓勵的劑型是注射劑,立項難度主要在於小劑型的工藝開發、兒童用法用量設計及安全性的臨床證據。促皮質素(ACTH)苯丙氨酸氮芥(馬法蘭)、重組人甲狀旁腺激素、多粘菌素E、胰島素樣生長因子-1和雙氫睾酮在我國暫無上市劑型,上市恐怕需要臨床試驗。
根據我國目前已上市產品的同通用名產品的說明書,並不是所有產品都有兒童用法用量以及兒童用藥臨床數據,部分產品僅僅在兒童用藥上注明“慎用”。對於禁止兒童口服或注射的產品,本次鼓勵目錄是推薦較溫和的外用劑型。如地西泮,幼兒中樞神經係統對地西泮異常敏感,注射劑中含苯甲醇,禁止用於兒童肌內注射,本次鼓勵目錄則推薦開發灌腸劑。
用法用量如何確定以及安全性如何保證,是改劑型和增加規格類項目的難點,現有的說明書並不能提供多大幫助。如根據苯妥英鈉說明書,新生兒或嬰兒期對苯妥英鈉的藥動學較特殊,臨床對中毒症狀評定有困難,一般不首先采用苯妥英鈉;學齡前兒童肝髒代謝強,需多次監測血藥濃度以決定苯妥英鈉用藥次數和用量。又如咪達唑侖說明書中提及尚無有關18歲以下兒童應用咪達唑侖,其年齡與藥效作用關係的研究,至今沒有文獻記載兒童用藥出現的問題;以及新生兒不應使用咪達唑侖等。
生產企業立項時需要參考美國等國外兒童指南從而確定用法用量。如鹽酸普萘洛爾口服溶液,在美國嬰幼兒的指南中推薦的用法用量為年齡小於等於2.5月者,1.0mg/kg/d;年齡大於2.5月者,1.5mg/kg/d。

分享到:














 相關新聞
相關新聞