
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




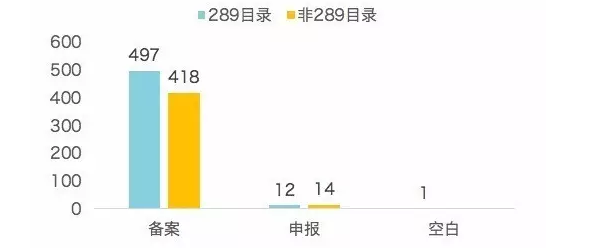
| 藥品通用名 | 當前備案企業數量 |
| 阿莫西林膠囊 | 22 |
| 辛伐他汀片 | 20 |
| 苯磺酸氨氯地平片 | 18 |
| 克拉黴素片 | 17 |
| 頭孢拉定膠囊 | 17 |
| 頭孢氨苄膠囊 | 17 |
| 奧美拉唑腸溶膠囊 | 16 |
| 馬來酸依那普利片 | 14 |
| 頭孢呋辛酯片 | 14 |
| 阿奇黴素膠囊 | 12 |
| 富馬酸喹硫平片 | 12 |
| 鹽酸二甲雙胍片 | 12 |
| 替米沙坦片 | 12 |
| 布洛芬片 | 10 |
| 阿奇黴素片 | 10 |
| 頭孢氨苄片 | 10 |
| 鹽酸雷尼替丁膠囊 | 10 |
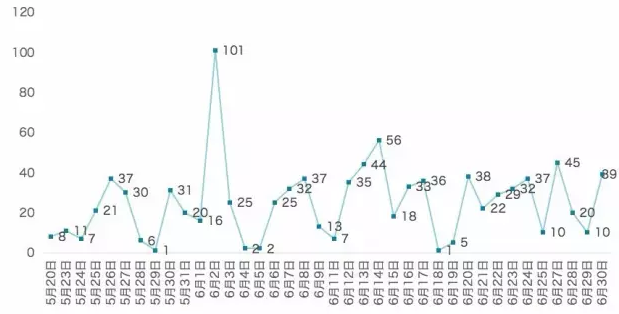
仿製藥一致性評價這場遊戲中,最難熬的恐怕是參與企業數量較多的藥品生產廠家,激烈的競爭會使得許多市場份額占比小的企業無力參與,從而選擇放棄。
2018 年底需完成一致性評價的企業數量在 300 家以上的品種有 14 個,當前有 9 個品種有企業提交了參比製劑備案,且備案企業數量非常少,例如諾氟沙星膠囊、甲硝唑片、鹽酸小檗堿片目前的備案企業都在 3 家左右,如果這個趨勢持續下去,可以預見這些品種的市場將迎來一次大洗牌。
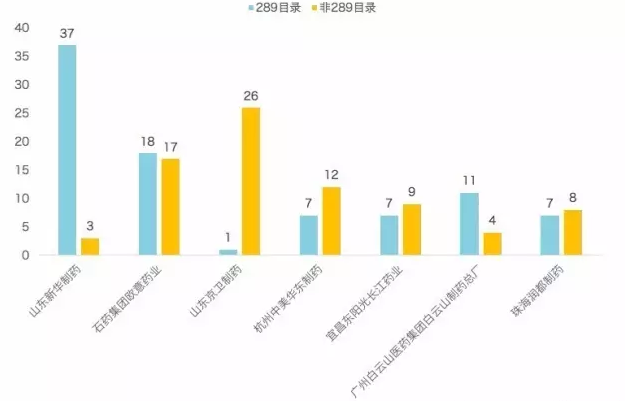
圖表 5. 競爭最激烈的 289 目錄品種當前備案情況
| 藥品名稱 | 劑型 | 規格 | 2018年底需完成一致性評價企業數量 | 備案企業數量 |
| 諾氟沙星膠囊 | 普通膠囊劑 | 100mg | 750 | 3 |
| 甲硝唑片 | 普通片劑 | 200mg | 657 | 4 |
| 鹽酸小檗堿片 | 普通片劑 | 100mg | 566 | 3 |
| 醋酸潑尼鬆片 | 普通片劑 | 5mg | 490 | 2 |
| 利福平膠囊 | 普通膠囊劑 | 150mg | 464 | 3 |
| 鹽酸雷尼替丁膠囊 | 普通膠囊劑 | 150mg | 443 | 10 |
| 頭孢氨苄膠囊 | 普通膠囊劑 | 125mg | 391 | 11 |
| 異煙肼片 | 普通片劑 | 100mg | 380 | 6 |
| 對乙酰氨基酚片 | 普通片劑 | 500mg | 376 | 1 |
根據第 99 號公告,仿製藥是指與被仿製藥具有相同的活性成分、劑型、給藥途徑和治療作用的藥品,也就是說,備案參比製劑的活性成分、劑型、給藥途徑需與擬評價品種一致。
然而,由於中國已上市仿製藥為改劑型改規格品種、原研品種撤市或失去參比製劑地位等原因,備案參比製劑的劑型規格與擬評價品種不一致,不一致的比例接近 30%,其中劑型不同的品種占 9%。
圖表 6. 擬評價品種與備案參比製劑劑型與規格一致情況的分布
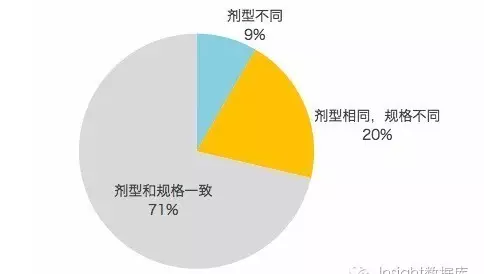
不一致的劑型與規格無疑增加了藥企完成一致性評價的難度,以下是 Insight 整理出當前備案參比製劑中與擬評價品種劑型不一致的表格,供小夥伴們參考:
| 擬評價品種劑型 | 備案參比製劑劑型 |
| 普通膠囊劑 | 普通片劑 |
| 普通片劑 | 普通膠囊劑 |
| 分散片 | 普通片劑 |
| 顆粒劑 | 普通片劑 |
| 腸溶膠囊 | 普通片劑 |
| 顆粒劑 | 普通膠囊劑 |
| 咀嚼片 | 普通片劑 |
| 顆粒劑 | 混懸劑 |
| 分散片 | 口腔崩解片 |
| 分散片 | 口服液體製劑 |
| 顆粒劑 | 口服液體製劑 |
| 腸溶片 | 普通膠囊劑 |
| 緩釋/控釋膠囊 | 普通膠囊劑 |
| 散劑 | 顆粒劑 |
| 分散片 | 混懸劑 |
| 普通片劑 | 緩釋/控釋膠囊 |
| 混懸劑 | 顆粒劑 |
 相關新聞
相關新聞