
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




近年來全球生物藥市場增長迅速,其中主要產品包括重組胰島素,人生長激素(HGH)和各種單克隆抗體(單抗mAbs)等。隨著許多暢銷的生物藥專利逐漸到期、降低醫療成本壓力的需求、以及新藥研發日益增加的難度,生物仿製藥市場顯示出強勁的發展潛力。生物仿製藥帶來的機 會及發展趨勢也成為醫藥界關注的焦點。同時,許多國家也正逐步完善生物仿製藥的審批政策,幫助生物仿製藥市場迎向快速發展的新時期。
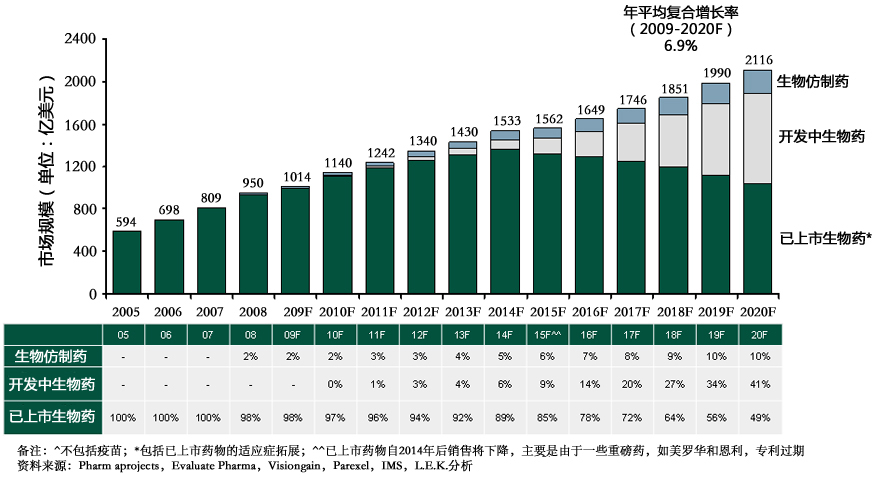
2005-2020年生物仿製藥、開發中生物藥、已上市生物藥發展預測
目前中國生物藥市場大約占整個中國藥品市場的20-30%,增速很快並且市場份額將會持續增長。已上市產品基本上是生物仿製藥,原研產品較少規模也相對較小,多為有特定市場的專科用藥譬如腫瘤藥。原研單抗藥物廠家,主要為外資主導,正持續擴展鋪貨渠道增加市場占有率。發展初期可能注重於大城市大醫院,但現在逐漸開始覆蓋到其它重要省會和中心城市。在中長期的規劃中,預計未來二三線城市會達到一線城市覆蓋率水平。即使是傳統觀念認為價格較貴的生物藥,未來也會有很好的發展空間。
目前國內生物製藥公司主要提供生物仿製藥概念的產品,一般是市場上比較成熟的藥。新藥在國內市場大部分仍在快速發展階段,雖然大多為外資主導,國內廠商也不乏發展機會。例如中國的胰島素市場規模非常大,有些國內廠家嚐試進入,比如通化東寶,但整體規模目前都很小。未來預計會有更多的國內廠家嚐試進入這些像是胰島 素及單抗類產品相對較高端的市場。
國內生物製藥公司想做單抗的公司非常多,主要分為兩類:第一類包括中信國健,江蘇泰康,百泰生物等,都是海歸回國後吸收小規模人群組建技術公司。這些公司大多處於較早的產品技術研發階段。第二類是比較傳統的生物醫藥公司,比如沈陽三生,一般利 用現有的生物行業技術經驗進入單抗領域。
中國的單抗市場目前主要分為腫瘤和風濕免疫,抗排異市場相對小很多。在單抗市場中,其中有9個進口的原研單抗。仿製藥方麵,已上市產品包括中信國健的益賽普,上海賽金的強克和百泰生物的泰欣生。
相對單抗來說,像EPO之類的第一代生物藥,雖然普及率較高,但是市場空間或者發展潛力並不及單抗,因為市場滲透率已較高且競爭非常激烈,若沒足夠優勢,再追加投入並不值得。
對於國內的生物仿製藥企業,還存在著產品定價的問題。以中國EPO市場為例,進口產品Kirin的利血寶價格為國產仿製藥的4倍,同時擁有較高的市場份額。國內產品隻能采取價低價競爭,造成整個市場競爭激烈,利潤空間小。除了三生之外,其他國內企業的份額大多很小。由此可見,今後中國企業做仿製單抗,如何在價格方麵有所突破且避免惡性競爭將是一個必須要考慮的問題。
相對化學仿製藥,生物仿製藥的注冊更加複雜並且是進入市場的主要關鍵。根據中國藥品注冊法規,除了正常申請臨床試驗批件和生產/進口批件的流程,化學藥的仿藥的臨床試驗僅需要完成生物等效性實驗。但是對於生物仿製藥,按照現行的規定則需按照新藥注冊且必須進行完整的臨床試驗。雖然某些情形下可以跳過第I、II期試驗,但第III期臨床試驗是必須要完成的。相應地,生物仿製藥的注冊時間和經濟成本都會增加,譬如如果臨床試驗觀察終點和指標不同,成本也會不 同。
目前國內很多大藥廠都在開發治療風濕免疫/腫瘤的單抗藥物。此類藥物通常需要進行大樣本量的第III期臨床試驗,僅試驗本身一般就要耗時兩三年,如果以總生存期為觀察終點,試驗時間和成本還將更高。同時從對臨床試驗的要求趨勢來看,不管是醫生(醫院的道德委員會)和SFDA,今後對於入組臨床試驗的病人可能會要求選擇目前市麵上公認相對好的治療方法,而不是隨便取一個簡單的治療方案作對照,因此未來臨床試驗的成本 有大幅增加的趨勢。
舉例來說,中信國健在2001年做益賽普 (Etanercept) 臨床試驗的時候,由於原研藥在國內還沒有上市,所以隻需與普通的抗風濕藥物(DMARDs)做對比即有可能獲得SFDA批準。但如果四五年後有其它公司要 做類似的新仿製藥,則有可能被SFDA要求與依那西普(Etanercept)原研藥(恩利Enbrel)做對照試驗,以證明在研產品有和依那西普(Etanercept)有相似的療效。如果這樣,根據目前對於臨床試驗例數的要求,實驗組需要有300例病人(不考慮病人脫落的情形),同時開發新藥的公司必須免費提供對照組約 100-150例病人6個月的恩利,試驗成本將大大高於以往隻供應普通抗風濕藥的費用。
由此可見,生物仿製藥在本身研發難度 之外,其注冊耗時長、臨床試驗成本高的特點也將成為另一種形式的壁壘。一些小公司可能覺得做化學仿製藥很容易,但是做生物仿製藥這一塊將會遇到很大的資金 壁壘。即使對有雄厚研發實力的公司,可能也還需借助社會資本和金融資本來加速產品開發。
目前中國尚無區分生物原研藥和仿製藥的注冊相關規定,所有生物藥都作為新藥進行審批。雖然還沒有出台注冊相關規定,第III期臨床試驗都將是必須的。這是因為對於原研藥廠家來講,製造生物藥的過程和步驟非常重要,不僅考慮身體吸收程度的藥代動力學(PK)方麵的比較。由於生物仿製藥實際上並不是真正完全跟生物原研藥一樣而隻是在某些性質上相似,其有效性和安全性需要更仔細的研究及驗證。舉例來說,在歐洲,一個生物藥廠換址,其產品都可能發生變化並需要嚴格的監管,甚至有可能被要求重新進行臨床試驗。因此未來生物仿製藥不做III期試驗就注冊的可能性很低,但III期臨床的規模和試驗方式或有討論空間。
除了臨床實驗的相關規定,目前歐洲的注冊規定允許如果一個藥有多個不同適應症,隻需做一個適應症的臨床試驗,而其他適應症隻需要做生物等效性實驗。因此通常節省一個生物仿製藥開發費用的方式之一是選擇其市場最大的或最容易證明的適應症做臨床試驗,再擴展適應症。值得注意的是,考慮到每一個生物藥都有不同的特性,在歐洲大部分生物藥的試驗要求都會根據每個案例的不同而有所變化。注冊規定一般隻提供基本框架,更多細節是通過與政府監管部門的討論製定出來。對於用於治療癌症的生物仿製藥,由於治療周期短,與政府討論空間也較多。
隨著各國生物仿製藥的審批政策的出台,這些新的政策對於中國有很高的參考價值。根據生物穀(Bioon.com)的報導,國家食品藥品監督管理局(SFDA)注冊司生物製品處副處長常衛紅在上海召開的2012中國抗體藥物研發與產業化國際峰會暨項目合作洽談會上表示,生物仿製藥指南製定的前期工作正在規劃中。生物仿製藥指南準備工作將包含調研、起草、實施的三個步驟。其中調研這部分工作已經開始,包括政策、質量控製、臨床前研究及臨床研究。指南內容將會匯集包 括科學家、研究者、國內外企業家等組成的顧問團隊所提供的意見。對照品設定、技術問題、相似度的審查難度及效益考慮等都將是指南需要研究的問題。
目前國內對於生物的規劃有很多,例如發改委的生物產業規劃中覆蓋麵包括醫藥工業,生物醫藥,生物產業等。“十二五”生物醫藥產業規劃中單克隆抗體藥物研究也 被列入國家重點項目。未來幾年隨著產業規劃啟動,中央財政扶持資金四百個億的也將陸續投入。工信部也從生物科技角度製定了發展規劃,內容包含很廣,從診斷 到農業技術都有涵蓋。但是工信部的規劃在內容和目標上並沒有特別針對生物藥,主要討論提高產業升級。比如說政府希望未來一類新藥達到25個,並沒有說明其 中化學與生物藥的比例。
此外,許多生物企業表示政府在逐漸加大對產品研發的支持。其中可能的趨勢是從研究機構牽頭轉為企業牽頭,先由企業發起,再加入大學等研究機構。因為研究機構牽頭往往沒有可商業化的成果,而企業牽頭有助於研究成果的商業轉化。
地 方政府對於生物製藥產業也提供很多優惠政策,包括稅收和財政上的支持,或者從更直接的藥物定價及醫保的影響。如中信國健的益賽普,在上海就有住院病人的補 貼政策,雖然這個補貼在申請過程中遇到了很多困難:上海政府認為單抗國內領頭企業及地方企業應該享有優惠政策;同時卻也需要顧慮醫保成本承擔太多,最後僅 允許在住院病人這裏醫保,雖然實際情況是益賽普多用於門診病人,而少用於住院病人。
對於國內的大型藥企,如何建立內部係統流程來增加新生物藥產品非常重要。其中一種可能的途徑是與海歸人士合作成立公司。比如複星在美國有投資一家小的公司專門做前期研發。這家小的公司剛開始的模式就是海歸人士做單抗的研究,回國後與複星投資成立公司,其中複星投資占80%股份。
海外並購有成熟技術的國外企業也有可能加速開發單抗的進程。一種方式是投資國外的公司,幫助其技術團隊增長,再利用他們資源在中國發展。例如藥明康德就在美國並購了專門做生物這一方麵的生物醫藥研發外包公司(CRO),再把美國技術引進到中國。
在當前的經濟情況下,並購美國公司不一定比中國公司貴。因為投資者預期中國市場增長率高,中國公司的市盈率倍數非常高,而美國現在給生物企業的估值相對中國來說較低。在2007年金融危機之後,美國有很多有好技術但是缺乏資金的公司麵對資金短缺的壓力且沒辦法往下一步發展。中國企業若有機會像複星一樣投資這些企業可能會是不錯的合作機會。若能並購到的企業有較為成熟的生物藥且市場規模較大,更可以直接引入中國做新藥。
通常在美國歐洲現行的中小型公司模式是將生物技術直接外包給合同生產外包廠家(CMO),發展到一定階段再自建或委托生產。把並購的公司所有營運移到中國不一定是個很好的模式,將研發與技術留在美國或歐洲而把生產遷到中國或許是一個更好的選擇。
生物仿製藥在中國有很大的市場發展潛力。未來幾年隨著政府在生物醫藥產業規劃的重點開展,生物製品研發的加速和醫藥內需的擴大,市場預計將以非常快速的速度增長。目前主要麵臨技術和監管方麵的難題及不確定性。國內生物仿製藥未來發展的機遇將主要取決於這兩方麵的發展。
在技術層麵,國內藥企生物藥品的研發、臨床研究及製藥等的技術水平跟生產工藝等都難以與國外相競爭。生物仿製藥在生產複雜性及仿製難度等方麵都比化學仿製藥高出許多,需要一個公司具備紮實的藥品研發知識、經驗和技術。這些條件對希望進入生物仿製藥市場的公司提出了更高的要求。不過國內的生物仿製藥企業正積極 地投資研發團隊及設備,並期望能縮小與國外廠家的差距。
在監管方麵,生物仿製藥的監管法規包括注冊管理、標準化與質量控製等都尚未明確。由於生物藥的驗證比化學藥更加複雜,製定監管政策的難度也相對提高。此外目前所有生物藥都按照新藥的流程進行審批,導致了生物仿製藥高昂的研 發成本和漫長的研發周期。隨著未來生物仿製藥指南的出台,市場的不確定性將降低,較新藥簡略的監管法規也將大力推動生物仿製藥的發展。
目前中國生物藥市場大多是仿製藥及缺乏技術含量並較普遍的藥品,單抗、疫苗和重組蛋白領域等較高端的生物藥市場主要為高價的原研藥,且品種較少。隨著眾多原研藥專利到期、高端的生物藥使用率性提高和生物仿製藥簡略申請政策出台,如果能在技術和監管方麵提供良好的條件,生物仿製藥有機會成為未來醫藥業的發展亮 點。
越來越多的中國醫藥公司開始進入到生物仿製藥領域尤其是單抗仿製藥領域,由於在該領域所需要的巨額投資,L.E.K.谘詢建議每個希望進入的國內醫藥公司在開始投入之前先衡量一下自己的實際情況和發展規劃:
? 公司是否已經有生物製藥業務,不管是自然提取還是重組技術?如果沒有,公司認為自己能夠在這個新興領域取得成功有哪些支持?
? 公司如何能夠快速建設自己的生物仿製藥能力?公司是傾向於自主技術開發還是通過技術轉讓(通過技術收購或者其他合作形式)亦或是收購的形式?
? 與眾多潛在的內資和外資生物仿製藥的競爭對手相比,公司有哪些特別之處?公司是否在自己所規劃的未來生物仿製藥所在的治療領域,如腫瘤或者風濕科,擁有有競爭力的產品和業務基礎?
? 公司是隻專注於中國國內市場,還是國際市場也是未來的發展方向?
? 如果國際市場也是未來份額發展計劃之一,那麽打算在什麽時間點拓展,拓展到哪些地區?公司如何預先規劃以在亞洲、拉丁美洲、歐洲和美國市場獲得收益?
未雨綢繆,規劃一個清晰的戰略對於所有的公司和業務永遠是一個正確的選擇。對於生物仿製藥業務而言尤其如此,因為就一個單抗仿製藥的開發、注冊、生產和營銷 的總成本至少要上億元。如果中國醫藥企業隻是重現九十年代大舉進入重組蛋白生產的“淘金潮”,這對於中國生物醫藥產業的聲譽和發展都是無利甚至有害的。首 先注重取得優質的、穩定的技術,高規格的質量順準以及臨床上優異的結果,那麽整個中國生物仿製藥產業在未來將獲得更大、更長遠的成功。
 相關新聞
相關新聞