
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com





生物分析能力是藥物臨床前研究和臨床研究的基石能力,是hjc黄金城這類CRO機構助力國內外客戶順利推進藥物開發進程的技術基礎。生物分析雖然是一門技術性很強實踐性很強的工作領域,如果僅就分析看分析,僅就技術本身思考技術對於研發過程中遇到各種情況和問題的解決可能會帶來思路上的局限性。做好生物分析工作,離不開技術實踐,更離不開相關基礎理論知識的支撐,實踐反饋理論,理論指導實踐,一些基礎理論不僅具指導價值,有時也具啟發性,有利於廣拓視角。hjc黄金城美研小編團隊推出生物分析係列專欄,邀請本領域的資深專業人員從不同的視角筆談生物分析相關的話題。
目前熱門和已上市的核酸藥物主要包括mRNA和寡核苷酸兩大類,mRNA既可以作為為疫苗,又可以作為治療性藥物,需要差異性地考慮其PK/PD的評估策略;寡核苷酸目前成藥的主要是ASO和siRNA,這些核酸藥物又兼顧了小分子與大分子藥物的一些PK/PD特征。
基因治療目前有多個不同層麵的理解,狹義基因治療一般定義是使用正常的基因替代、糾正異常的基因,或者將異常的基因敲除以達到治療疾病的目的。基於中心法則上去理解,狹義的基因治療也可以從另一個層麵定義為通過糾正中心法則過程中出現的問題,如基因突變導致的功能性蛋白質缺失或異常等(參見圖1和圖2),以達到治療疾病的目的。在廣義的基因治療概念下,溶瘤病毒、細胞治療,核酸類藥物均可被納入基因治療的範疇,但並不是所有的核酸藥物都屬於基因治療範疇,如mRNA藥物僅有一部分可以被納入基因治療的範疇。
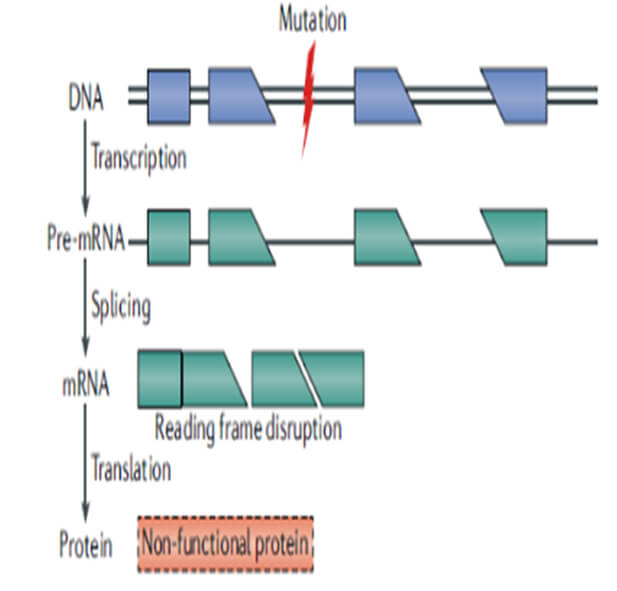
圖1. 基因突變影響開放閱讀框而不能形成有功能的蛋白
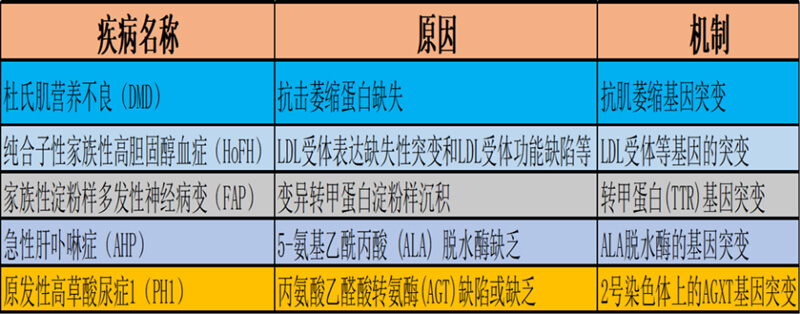
圖2. 部分寡核苷酸藥物針對的遺傳病
目前的基因治療領域有兩個離不開核酸的有趣的現象,即RNA幹擾和CRISPR基因編輯。RNA幹擾和CRISPR基因編輯也都是一種生物體內抗病毒感染的免疫機製,是在核酸水平上的免疫,有人稱其為基因免疫或基因組免疫。而經典的免疫學裏涉及的免疫係統中的免疫分子包括抗體、補體、配體、受體和細胞因子等成分一般都是氨基酸為基本組成單元的分子,沒有核苷酸作為基本組分的分子的直接參與。
未來是否有更多類似於RNA幹擾和基因編輯的核酸層麵的機製被發掘而可能會進一步地豐富我們對免疫學的認知,並且在基因組免疫領域的概念會越來越豐富、發展,甚至逐步成為免疫學的一大分支,或許也能作為我們的一種額外期待。
核酸藥物經過幾十年的積累,在近幾年達到了爆發期。目前國內外上市的基因治療藥物主要是mRNA疫苗和主要針對遺傳病的寡核苷酸類藥物(如圖3)。所以本文主要將核酸類藥物分為mRNA藥物和寡核苷酸藥物兩類,分別進行簡要闡述。
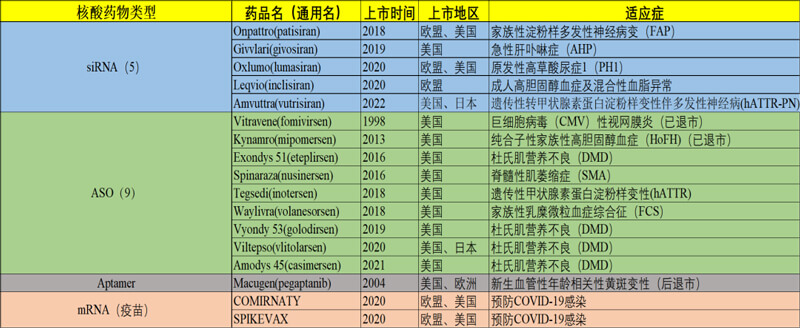
圖3. 國際上市的主要核酸類藥物(截至2023年3月,暫未列國內廠家產品)
mRNA藥物的優勢包括:
(1)可以導入細胞,在體內直接表達目的蛋白;
(2)mRNA的降解通過細胞正常代謝完成,無明顯的毒性;
(3)既能刺激體液免疫,又能刺激細胞免疫應答;
(4)既可以開發為疫苗,又可以開發為治療性藥物等。
mRNA藥物的缺點包括:
(1)不穩定,易被核酸酶等降解;
(2)製備工藝複雜;
(3)使用純生物藥的生產路徑;
(4)需要超低溫運輸等。
製定mRNA產品臨床前藥代動力學藥效學(PK/PD)考察分析策略的前提是判斷其屬於疫苗還是治療性藥物。兩者存在以下不同:
(1)編碼蛋白的性質不同,mRNA疫苗編碼病毒或腫瘤抗原蛋白,一般少量蛋白表達就可以發揮作用, 治療性藥物則通常需要更高的蛋白表達量;
(2)遞送要求不同,疫苗無需組織特異性,mRNA治療性藥物則期望遞送到特定的組織後進行翻譯表達;
(3)給藥方式不同,目前上市和在研mRNA疫苗多為肌肉注射,治療性藥物則根據具體治療性質常采用係統給藥,甚至靶組織局部給藥;
(4)遵循的法規不同,mRNA疫苗需要遵循疫苗的指導原則,免疫原性屬於其PD指標,而治療性藥物則不同的遵循,免疫原性也非是研發者所期望。
mRNA疫苗可以在細胞內表達病毒或細菌蛋白,刺激機體產生免疫保護性抗體,或者表達腫瘤新生抗原,從而製備個性化腫瘤疫苗。部分mRNA疫苗如針對基因突變產生的腫瘤新生抗原開發的疫苗,可以被認為是基因治療產品。但另一部分mRNA疫苗表達病毒抗原如新冠疫苗可直接表達SARS-CoV-2的刺突蛋白或刺突蛋白的RBD結構域,誘導機體產生免疫應答,一般不認為是基因治療產品,故如前所述隻是部分mRNA產品屬於基因治療範疇。
mRNA疫苗臨床前PK/PD考察分析的要素主要有:
(1)預防用生物製品的指導原則中指出疫苗通常不需要進行常規的藥代動力學研究,但某些特殊類型疫苗應需要進行生物分布的研究;
(2)非臨床研究中,需要研究mRNA和脂質納米顆粒(LNPs)或其它脂質成分是否在接種疫苗的組織中分布,它們分布在哪些組織中,以及它們的持續時間。
(3)作為疫苗一般不用分析表達產物,但其表達產物的免疫原性相當於其重要的藥效指標。
基於mRNA疫苗的機製和效果,對於免疫原性方麵,既要考慮結合抗體又要考慮中和抗體,不僅考慮B細胞免疫還要考慮細胞免疫(參見圖4),與治療性藥物相比,mRNA疫苗的免疫原性很強,一般不需要使用高成本高靈敏的檢測技術進行結合抗體的檢測。
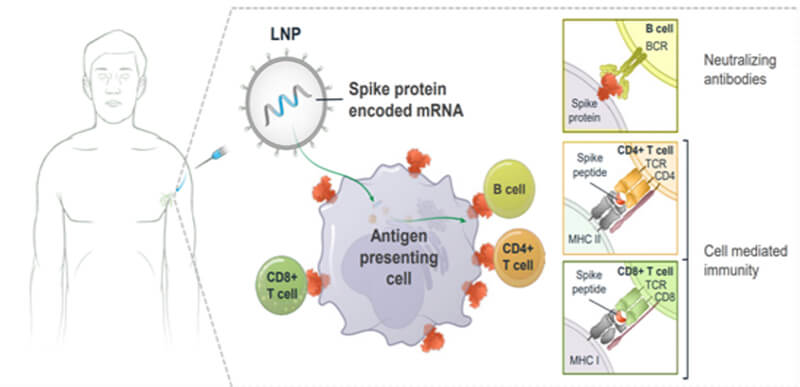
圖4. mRNA疫苗作用機製示意圖
mRNA治療性藥物有如下效用方式:
(1)抗體效用,即直接表達用於治療當前和新發疾病的預防性或治療性抗體;
(2)蛋白替代療法,即直接表達一種人類蛋白來解決遺傳疾病,如血友病;
(3)基因編輯/堿基編輯,即表達基因組編輯蛋白或堿基編輯蛋白來修飾人類基因表達。
mRNA治療性藥物通過編碼功能性治療蛋白,由所表達的蛋白產物發揮治療作用。該類藥物的臨床前PK/PD分析需要有以下兩個考慮點:
(1)PD的持續與mRNA產物的表達量和表達時相相關,即存在一定的量效關係;
(2)藥物的PK研究如吸收和分布的研究有利於評價量效關係。
mRNA治療性藥物的臨床前PK/PD分析需要考查的要素有:
(1)PK分析:即mRNA濃度隨時間變化的分析;
(2)將表達產物,即目標蛋白的表達量與分布作為PD指標進行分析;
(3)脂質體成分的藥代分布分析,尤其是新型脂質輔料。
此外,PK/PD與免疫原性間通常具有關聯性,對於mRNA治療性藥物需要同時分析mRNA本身和脂質體成分的免疫原性影響,聚乙二醇化LNP產生抗體已有報道,抗PEG抗體已被廣泛研究和報道,筆者所在機構也分析出LNP的PEG成分可見一定程度的免疫原性,筆者所在機構表達IgG1亞型抗體的治療性mRNA產品在食蟹猴靜脈給藥的PK/PD試驗例中全麵兼顧了本文所列要點。
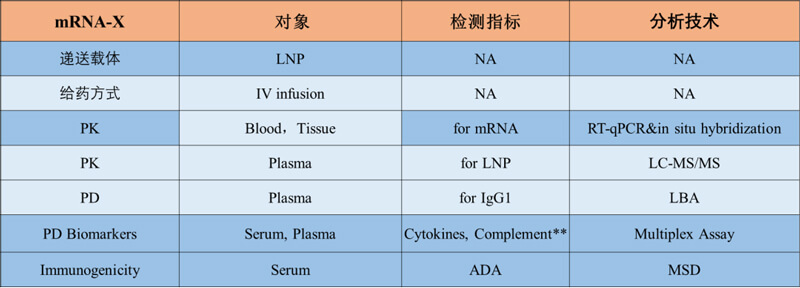
圖5. mRNA治療性藥物的PK/PD研究設計實施例
目前寡核苷酸類產品成藥上市的主要為反義寡核苷酸(ASO)與siRNA,而miRNA研發進入臨床試驗的極少,所以本部分的分析僅以ASO與siRNA藥物為代表。ASO和siRNA的主要區別在於,前者是單鏈,後者是雙鏈RNA。而雙鏈的siRNA作用機製與RISC形成有關,RISC可反複作用靶標mRNA; siRNA被釋放的正義鏈或被降解,也可作為引物,在RNA依賴的RNA聚合酶的催化下以靶mRNA為模板擴增得到dsRNA,dsRNA又可被Dicer降解成siRNA,進入RNAi循環,所以藥物效果更持久甚至有級聯放大效果。
寡核苷酸類藥物的PK特征包括:
(1)靜脈給藥和其它途徑給藥,藥物進入靶部位的方式不同,導致體內的PK過程也不一樣;
(2)裸siRNA不穩定,易被血液和組織中核酸酶降解;
(3)容易在肝髒和腎髒中聚集,並經腎髒排泄;
(4)非腦內給藥時,不易過腦;
(5)兩條鏈被修飾的方式不一樣,導致兩條鏈的PK參數比如峰濃度和暴露量不一致;
(6)在給藥局部存留時間長;
(7)血液清除速度要快於組織;
(8)目前的藥物基本都為體外合成的RNA分子,可被免疫係統吞噬,有些還會激活天然免疫,如toll樣受體參與引發免疫反應,比如幹擾素(IFN-α、IFN-β)、細胞因子(TNF-α、IL-6)產生等。寡核苷酸藥物主要經核酸內或外切酶代謝為短核苷酸碎片,和蛋白類藥物被蛋白酶切割降解為氨基酸類似,所以寡核苷酸藥物與傳統大分子藥物的代謝上有雷同之處,但許多寡核苷酸現實又多見修飾,其代謝產物分析仍需周全考慮;另其分子量是遠大於小分子和一些多肽,分子量較大,需要考慮免疫原性潛在的對其PK/PD特征的影響。
寡核苷酸類藥物PK/PD考察分析的策略要點主要包括:
(1)按照小分子藥物PK研究思路設計相關研究內容;
(2)兼顧其大分子藥物的部分特征,考慮免疫原性的影響,如抗藥物抗體(ADA)的分析,考慮代謝清除緩慢的特點;
(3)對於siRNA,分析反義鏈和有義鏈所表征的PK行為是否有差異;
(4)必要時,注意考察製劑輔料的PK特點;
(5)設置相應PD指標,如新功能蛋白的水平變化;
(6)適當設置細胞因子、補體等PD生物標誌物指標,針對輔料如PEG的抗體檢測;
(7)利用合適平台技術開發滿足實際靈敏度需求且穩定的PK生物分析方法是一大挑戰。
分析寡核苷酸類藥物的PK/PD,離不開對其免疫原性的察。因為寡核苷酸類藥物是外源性核酸分子,分子量偏大,並且是潛在的弱抗原或半抗原。而免疫原性產生的主要原因可能與其產品因素、產品的藥理學因素以及給藥對象因素有關,藥理學因素以及給藥對象因素具體機製與其它大分子的這兩方麵因素大致相同,重點要考慮該類產品潛在引起免疫原性的本身的產品因素的不同如鏈型、堿基序列、堿基修飾、遞送載體成分、骨架修飾等。免疫原性的考察點的考慮基於siRNA等寡核苷酸的外源性性質,宿主係統會將其視為病原體,免疫係統可以通過細胞外和細胞內不同的病原相關分子模式(PAMP)受體識別單鏈和雙鏈RNA與toll樣受體(TLRs)相互作用產生免疫應答;以及TLRs刺激炎症細胞因子和I型幹擾素(IFN)的過量產生的免疫反應。既要考慮體液免疫分析,又要考慮除寡核苷酸本身外的載體成分,甚至藥效機製發揮而生成的新的功能性蛋白成分的免疫原性。
核酸類藥物尤其是寡核苷酸類藥物,對生物分析帶來了巨大的挑戰。寡核苷酸類藥物的分子量不大不小、並存在藥物不穩定、鏈型、修飾、弱免疫原或半抗原(導致特異陽性抗體的製備存在現實困難)等特征,這些都是構成其分析挑戰的幾大因素。
目前主要有5種主流技術可以進行核酸類藥物的PK分析,包括PCR技術、H-LBA、b-DNA、基於雜交的LC-UV/PL以及LC-MS/MS和LC-HRMS(圖6)。
其中,qPCR技術可以方便地檢測長度較長的核酸類藥物,靈敏度高,檢測範圍寬,但是需要複雜的樣品處理過程;ddPCR靈敏度更高,但耗材費用高,成本高;對於較短的核酸檢測來說,雖然也可以通過莖環qPCR(Stem-Loop qPCR)的設計實現,實施相對於較大的核酸要複雜。H-LBA方法的特異性高,靈敏度好,但是檢測效果非常依賴於探針的可靠性和設計技巧及反應過程細節的優化;b-DNA方法其實是H-LBA技術的拓展版,有很高的特異性、準確性和更高的靈敏度,但檢測效果同樣高度依賴於特殊的探針設計及雜交反應技術細節;基於雜交的LC-UV/FL方法可以測定較長核酸類藥物,具備較好的特異性和準確性,但是樣品處理複雜,靈敏度對熒光探針的準確性高度依賴;LC-MS/MS和LC-HRMS方法也可以用於核酸類藥物的分析,選擇性好,可以區分全長和代謝產物,但是對非修飾的寡核苷酸類藥物檢測靈敏度和特異性相對較差,並且價格昂貴,不適宜測過長的核酸分子。其它的活體熒光成像,同位素示蹤、原位雜交、熒光原位雜交等分析技術可以作為補充手段,應用於不同的目的和研究階段,但它們的精準度差,不大適合作為後續的驗證用方法。
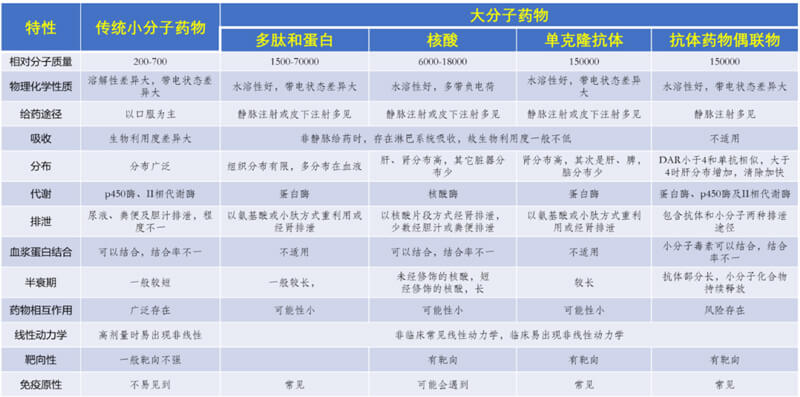
圖6. 核酸類藥物生物分析的主流技術對比
近年來,核酸類藥物是近幾年來最熱門一大新藥研究方向。但核酸類藥物尤其是寡核苷酸類藥物與傳統小分子與大分子藥物成分存在顯著區別,給核酸類藥物的生物分析和PK/PD考察帶來了較大的技術挑戰。mRNA藥物作為疫苗和治療性藥物時考慮點不同,寡核苷酸類藥物同時兼顧了大小分子的一些PK/PD特征,需要根據具體的分子特征選擇PK/PD考察評估策略和分析的技術應用策略。
[1]. Sun, H., et al., mRNA-Based Therapeutics in Cancer Treatment. Pharmaceutics, 2023. 15(2).
[2]. Takakusa, H., et al., Drug Metabolism and Pharmacokinetics of Antisense Oligonucleotide Therapeutics: Typical Profiles, Evaluation Approaches, and Points to Consider Compared with Small Molecule Drugs. Nucleic Acid Therapeutics, 2023.
[3]. Munter, R., et al., Studying how administration route and dose regulates antibody generation against LNPs for mRNA delivery with single-particle resolution. Mol Ther Methods Clin Dev, 2023. 29: p. 450-459.
[4]. Mu, R., et al., Bioanalytical Methods and Strategic Perspectives Addressing the Rising Complexity of Novel Bioconjugates and Delivery Routes for Biotherapeutics. BioDrugs, 2022. 36(2): p. 181-196.
[5]. Nonclinical Testing of Individualized Antisense Oligonucleotide Drug Products for Severely Debilitating or Life-Threatening Diseases; Draft Guidance for Sponsor-Investigators; Availability. 2021, Federal Information & News Dispatch, LLC: Washington. p. 22213.
[6]. Krienke, C., et al., A noninflammatory mRNA vaccine for treatment of experimental autoimmune encephalomyelitis. Science, 2021. 371(6525): p. 145-153.
[7]. Bioanalytical Methods and Strategic Perspectives Addressing the Rising Complexity of Novel Bioconjugates and Delivery Routes for Biotherapeutics.
[8]. Hirabayashi, Y., et al., Considerations of the Japanese Research Working Group for the ICH S6 & Related Issues Regarding Nonclinical Safety Assessments of Oligonucleotide Therapeutics: Comparison with Those of Biopharmaceuticals. Nucleic Acid Therapeutics, 2021. 31(2): p. 114-125.
[9]. 預防用生物製品臨床前安全性評價技術審評一般原則.NMPA, 2005.
[10]. 治療用生物製品非臨床安全性評價指導原則.NMPA, 2007.
[11]. 彭雙清,郝衛東. 藥物安全性評價關鍵技術[M]. 北京: 軍事醫學科學出版社, 2013.
[12]. Evaluation of the quality, safety and efficacy of messenger RNA vaccines for the prevention of infectious diseases: regulatory considerations. WHO, 2021.
 相關新聞
相關新聞