
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com





化合物在晶體狀態時,由於分子在晶格中具有不同的排列或構象,形成不同的晶型。原料藥不同晶型可能具有不同的物理和化學性質,可能對原料藥及製劑的穩定性、製劑的生產工藝、溶出度及生物利用度等產生影響,進而可能影響藥物的安全性、有效性和質量可控性,在製藥工業中,選擇合適的固體形式進行藥物開發是極其重要的,對固體形態的全麵了解,對於選擇固體形態以及開發穩定的生產工藝和安全的藥品至關重要。
對於藥物晶型,需要建立一個全麵的控製策略,以確保藥品的質量。這種策略應基於對晶型的徹底篩選和研究、相關形態的全麵表征以及對原料藥和製劑生產工藝的理解。整體控製策略包括四個要素:(i)固有屬性,(ii)工藝參數,(iii)工藝過程,(iv)檢測。
(i)固有屬性:晶型控製的策略是根據所選晶型的內在特性進行選擇。例如,選擇熱力學穩定的晶型更有助於晶型的控製,因為熱力學驅動力總是將轉換導向吉布斯能量最小值。相反,選擇非晶形式需要特殊的預防措施,以確保形成非晶形式,並防止晶型轉變,即在藥品生產和儲存期間的結晶。
(ii)工藝過程:描述與晶型控製相關的設計措施和操作,如單元操作順序和溶劑選擇(一般為工藝設計),還包括設施設置或設備配置,以防止不希望看到的晶型成核和生長。這方麵的一個例子是使用幹製粒來防止水合物的形成。
(iii)工藝參數:參數控製包括控製與晶型相關的(關鍵)工藝參數的所有措施,例如,添加晶種的質量和數量,冷卻結晶時的濃度、起始溫度、冷卻速度,終點析晶溫度、析晶時間;反溶劑結晶時混合順序,添加速度;粉碎過程中的機械力;壓片時的壓力,烘料溫度等。
(iv)檢測:包括中間體、原料藥和藥品的過程控製、規格和分析測試,以確保它們的形成所需的目標晶型。
原料藥固體形態控製策略的製定基於ICH Q6A決策樹#4,並遵循質量源於設計(QbD)。如果晶型篩選實驗(可與理論計算機預測結果相補充)沒有揭示不同的晶型存在,則不需要進一步的研究。然而,如果確定具有不同的晶型,不同的晶型具有不同的物理化學性質,如熱力學性質、動力學性質、機械性質、表麵性質、光學性質等,這可能會影響藥物的療效、可加工性或物理化學穩定性。由於對所有非理想的晶型開展安全性和有效性研究幾乎是不可行的,因此建議對最終原料藥采用的晶型進行屬性控製。
ICH Q6A指南的決策樹#4也描述了藥品的控製策略。該指南決策樹表明,如果對患者的療效或安全性可能有影響,則應建立晶型的可接受標準。然而,建立這樣的標準和開發適當的分析方法具有挑戰性(通常的固態定量分析方法定量限高、誤差大),特別是對於載藥量低的藥物,應盡可能避免建立晶型的可接受標準。其基本原理旨在提供對多晶型現象的全麵了解,涵蓋藥品整個生命周期的生產和儲存過程中所有導致晶型變化的因素。實驗必須證實晶型變化的可能性是可以忽略不計的。
下麵的案例研究描述了開發原料藥、藥品晶型的整體控製策略。由於該藥品含有較低的載藥量,因此建立了科學的理論基礎來支持該策略,即根據ICH Q6A,藥品質量不需要製定晶型接受標準。
對某原料藥多晶型篩選結果顯示,除了無定型外,還有三種晶型(Form A、Form B和Form C)。未發現水合物或溶劑化物。選擇熱力學穩定的Form B進行開發(固有屬性,見下表1)。Form B的熔點為163°C,不吸濕,在固態下表現出良好的化學穩定性。Form A是一種非吸濕的亞穩晶型,在熔化時轉變為Form B。Form C和無定型在環境條件下轉變為Form A。
基於臨床中預期的低劑量和體外細胞滲透性高,盡管在水中溶解度較差,但Form B的原料藥仍可被歸類為生物製藥分類係統(BCS)中的I類化合物。開發了加晶種的冷卻結晶工藝,以確保穩定獲得Form B (過程/參數控製)。對於晶型控製,該過程被證明是高度可重複性的。即使以Form A作為晶種添加,也會形成Form B,這表明有很強的熱力學驅動力。
采用氣流粉碎來達到所需的粒徑分布。眾所周知,粉碎可能導致部分非晶化。然而,差示掃描量熱法(DSC)和x射線粉末衍射(XRPD)對新粉碎樣品的檢查沒有顯示出任何非晶化或晶型轉變。因此,製定非晶態含量的標準被認為是不必要的。最後,通過檢測控製,對原料藥進行XRPD放行測試,以確定所需的晶型。XRPD對Form B中Form A的檢出限約為3%。
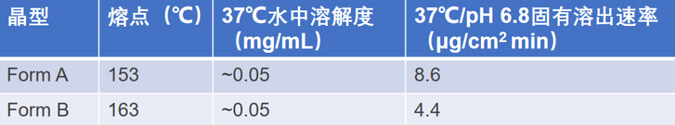
表1 Form A和Form B的物理化學屬性
對於商業配方,開發了1 mg和5 mg劑量的口服包衣速釋片。原料藥懸浮在造粒液(水性粘結劑溶液)中,以便在流化床造粒過程中均勻分布在粉末床中。幹燥和篩分後,將顆粒與其他輔料混合,隨後進行壓片和薄膜包衣。
在粘合劑溶液中的溶解度被假定為與晶型控製相關的潛在關鍵。在濕製粒過程中暫時溶解的原料藥組分可能在隨後的蒸發/幹燥步驟中重新凝固成另一種晶體形式。在預期的最高工藝溫度(35°C)下,Form B在水性粘合劑溶液中的溶解度約為0.1 mg/ml。因此,Form B的溶解部分約為配方中懸浮的總原料藥的0.6%。因此,99%以上的固體形態不受影響,並且溶解部分不受控製的自發結晶的相關風險非常低。此外,可以排除向水合物的轉變,因為在多晶型篩選活動中沒有發現水合物。
為評估在壓片過程中轉晶的可能性,測試了原料藥在壓力下的轉晶行為。在300mpa的壓力下,沒有觀察到該化合物固態轉化的跡象,這遠遠高於壓片過程中施加的壓力(參數控製)。在濕法包衣過程中,素片再次暴露在高溫的水中。與濕法製粒工藝(見上文)的考慮相似,得出的結論是,即使是濕法包衣的最後一步也不會誘導任何固體形態轉變。
本案例表明,通過固有屬性、工藝參數、工藝過程和檢測的控製策略控製藥物固體形態,經科學推斷,也能被監管部門所接受,無需進行繁瑣的固態定量分析方法的開發,亦可避免建立晶型的可接受標準,以省略最終製劑產品的晶型控製。
hjc黄金城可為您提供係統且全麵的藥物晶型研究,包括晶型的篩選製備、表征、溶解性和溶出度研究、晶型轉化關係研究、晶型穩定性考察,建立有效晶型質量控製方法等。對藥物多晶型現象進行深入的研究和探討,為藥物的優勢晶型選擇、有效晶型的檢測控製、生產工藝的優化、貯存運輸條件的確定、質量標準的製定等提供依據,以確保藥品的有效性、安全性與質量可控。
參考文獻:
Polymorphism in the Pharmaceutical Industry: Solid Form and Drug Development.
美研|CMC係列回顧
 相關新聞
相關新聞